Intellia Therapeutics周四上午宣布,美国FDA批准其在美国进行针对遗传性血管性水肿的体内基因编辑疗法NTLA-2002的临床试验[2]。
据药融云数据库,Intellia已经在新西兰、荷兰和英国进行早期临床试验,获得FDA批准后,Intellia将在美国进行第二阶段临床试验。
NTLA-2002临床试验信息
截图来源:药融云全球临床试验数据库
虽然Intellia已经在其他国家的人群中测试了其体内基因编辑疗法,但FDA这次的决定代表首次签署“体内”基因编辑疗法人体测试。在此之前,FDA只允许在人体中进行离体基因编辑疗法测试。所以这是一个重要里程碑,因为Intellia的NTLA-2002是FDA批准的第一个用于人体的体内基因编辑疗法。与此同时,该决定为后续寻求FDA批准的“体内”基因编辑疗法项目打开了大门[4]。
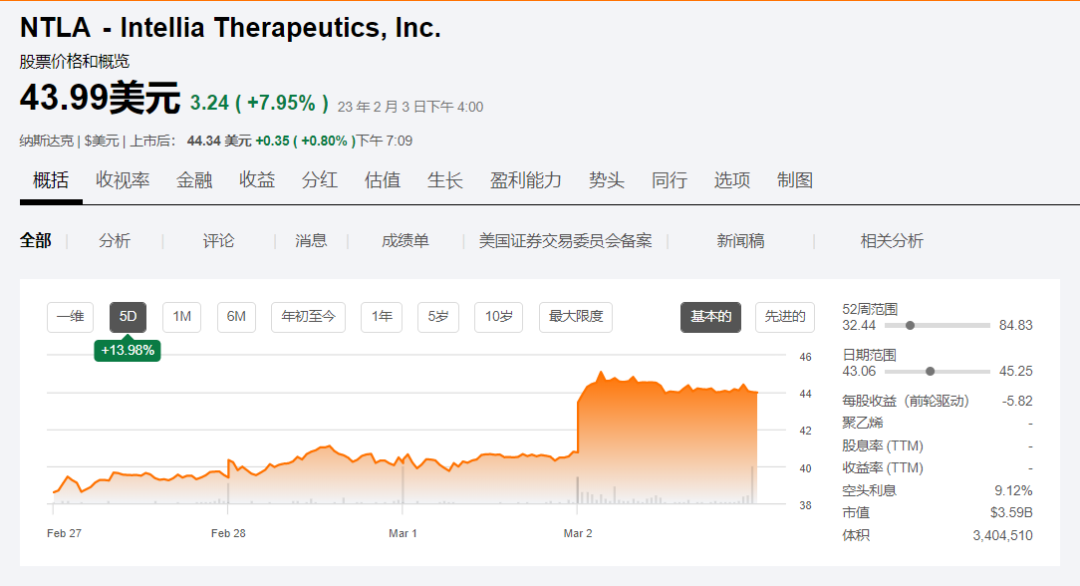
受此影响,Intellia周四股价上涨8%。Intellia是由CRISPR基因编辑技术奠基人、诺奖得主Jennifer Doudna创立的基因编辑治疗公司,目前市值约35.9亿美元。
一、遗传性血管性水肿
遗传性血管性水肿(HAE)是一种罕见遗传性疾病,大约50000人中有1人患病,未经治疗的患者平均7-14 天发病一次。按这个比例推算,我国HAE患者大概在2万到3万之间。然而,目前我国已知临床确诊的患者仅500多例,诊断率不足2.5%[5]。
本病多数有家族史,可发生于任何年龄,通常在30岁前起病,青春期加重,常伴腹痛、恶心呕吐、血清中C1酯酶抑制物(C1-INH)降低等表现[1]。针对HAE,目前没有治愈方法,只能进行早筛早诊早治,缓解相应不适症状。
二、NTLA-2002
Intellia第一款体内基因编辑疗法是NTLA-2001,用于治疗转甲状腺素蛋白淀粉样变性。预计今年年中提交美国申请,并在年底前开始后期研究。
NTLA-2002作为Intellia第二款体内基因编辑疗法,旨在通过LNP递送CRISPR基因编辑靶向肝脏细胞的KLKB1基因,从而抑制激肽释放酶的产生,进而抑制缓激肽的产生,而缓激肽的过度产生会导致遗传性血管性水肿的发作。
Intellia体内基因编辑疗法研发管线
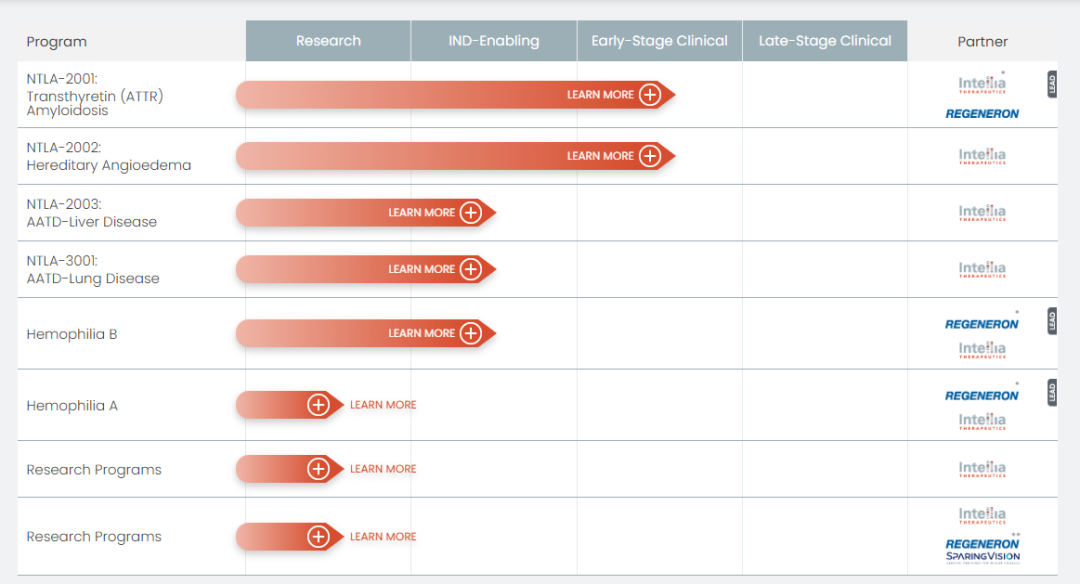
来源:Intellia官网
Intellia去年披露了NTLA-2002早期研究结果:截至2022年 9月28日,三名接受低剂量(25mg)NTLA-2002治疗的患者在5-10个月内没有发作,而且这个时间还在增加。预计2023年,Intellia将发布更多关于NTLA-2002的数据。

Intellia总裁兼首席执行官John Leonard
Intellia总裁兼首席执行官John Leonard提到:“Intellia最初决定在英国开始临床试验,因为那里的监管机构高度支持体内基因编辑疗法。所以我们做出判断,在美国以外的地方进行试验,可以让我们更快获得临床数据。”
除了Intellia外,其实还有几家公司布局体内基因编辑疗法,可惜结果都不理想:要么被暂停,要么停止试验,要么未招募患者,具体情况如下:
- 2022年11月7日,Verve Therapeutics透露,FDA已暂停了其体内碱基编辑疗法Verve -101的临床试验申请,该疗法用于治疗杂合子家族性高胆固醇血症。这可是世界上首个人体内碱基编辑的临床试验,标志着碱基编辑开始进入临床。
- FDA还批准了少数用于人体试验的体内基因编辑疗法,包括Editas和Excision用于治疗Leber先天性黑蒙10型的体内基因编辑疗法EDIT-103;Sangamo用于血友病B的体内基因编辑疗法SB-FIX; LogicBio用于甲基丙二酸血症的体内基因编辑疗法LB-001。但是在数据显示药物无效后,Editas正在结束其试验,而Sangamo在仅招募一名患者后于2021年终止了研究。LogicBio被阿斯利康收购后,其试验目前显示“未招募”。
其实,美国一直不太接受体内基因编辑疗法,一是民众对该疗法的利弊尚不完全清楚,二是具有宗教信仰的民众认为基因编辑技术是一种对自然的挑战。此次Intellia体内基因编辑疗法在美国获批临床试验,具有里程碑意义。
参考资料:
[1]百度百科
[2]Intellia官网
[3] 药融云数据库
[4]https://www.biopharmadive.com/news/Intellia-fda-crispr-in-vivo-gene-editing-ind/643999/
[5]支玉香, 等. 遗传性血管性水肿的诊断和治疗专家共识. 中华临床免疫和变态反应杂志, 2019, 13(1): 1-4.
<END>











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论