
文 | 番茄
封面 | Pixabay
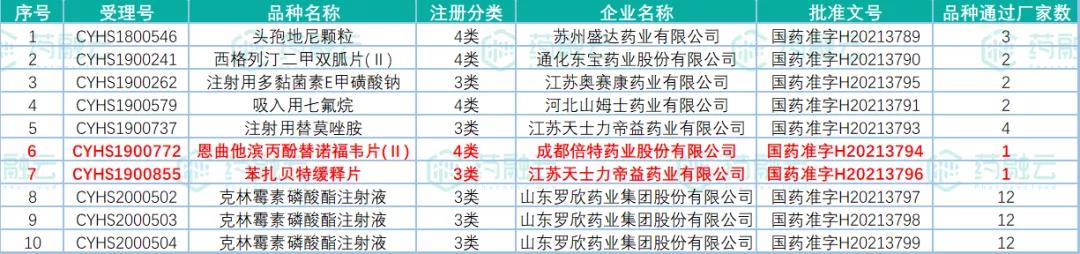
2021年10月20日,国家药监局发布药品批准证明文件待领取信息,其中包括18个药品通过或视同通过一致性评价。此次过评的药品剂型包括片剂、注射剂、颗粒剂和吸入剂。其中,有3款药品为首家过评,分别是四川升和药业的盐酸多奈哌齐口崩片、成都倍特的恩曲他滨丙酚替诺福韦片(Ⅱ)和江苏天士力帝益药业的苯扎贝特缓释片。
图1:10月20日药品批件信息
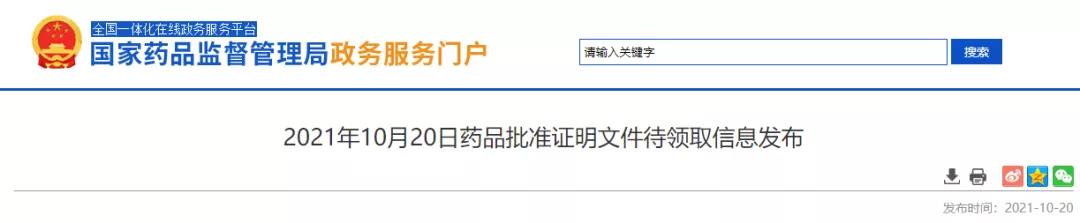
表1:通过一致性评价品种
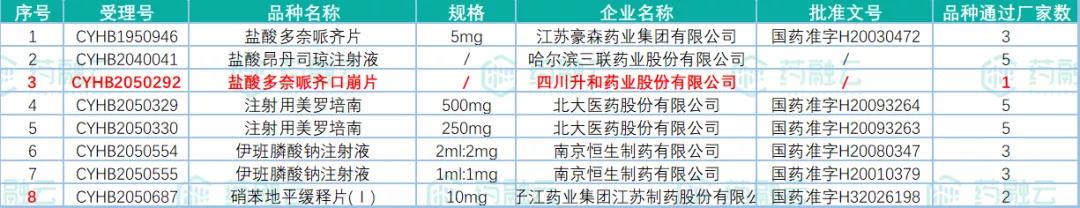
表2:视同通过一致性评价品种
数据来源:药融云中国药品审评数据库
药融云一致性评价数据库
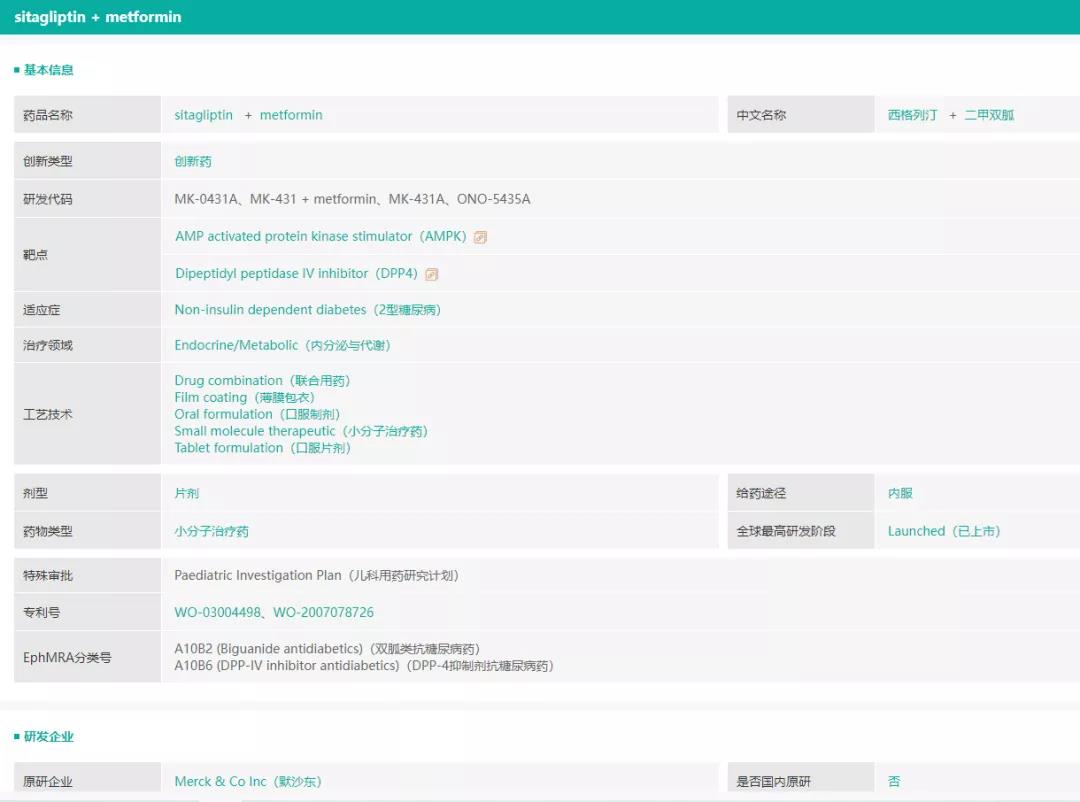
Ⅱ型糖尿病药物「西格列汀二甲双胍片(Ⅱ)」,又添一过评企业
西格列汀二甲双胍片(Ⅱ)(商品名:捷诺达)由默沙东原研开发,2007年3月在美国上市,用于2型糖尿病的口服治疗,次年在欧盟获批上市,2012年我国批准进口。
西格列汀属于高度选择性DPP-4类小分子抑制剂,DPP-4抑制剂其降糖机制是通过促进肠道内肠促胰素的分泌,实现对胰岛素分泌的灵活控制,被称为“智能”降糖药;二甲双胍为双胍类口服降血糖药物,是目前糖尿病用药指南推荐的一线用药。西格列汀二甲双胍片是两种作用机制互补的降血糖药物复方,配合饮食和运动治疗,用于经二甲双胍单药治疗血糖仍控制不佳或正在接受二者联合治疗的2型糖尿病患者。
图2:“西格列汀二甲双胍片(Ⅱ)”的基本信息
数据来源:药融云全球药物研发数据库
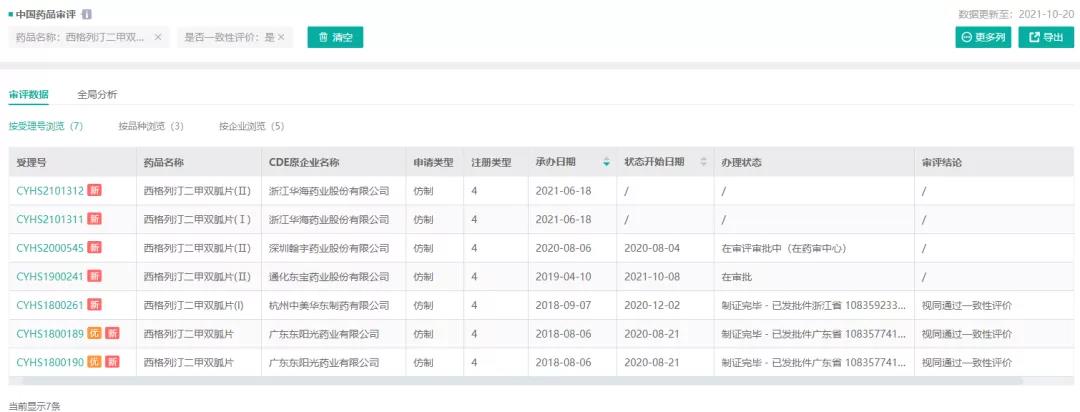
根据药融云数据显示,通化东宝药业为西格列汀二甲双胍片(Ⅱ)过评的第2家企业。西格列汀二甲双胍片的全部过评企业信息历程如下:
- 2018年8月,扬子江药业提交其4类仿制药西格列汀二甲双胍片(Ⅲ)和西格列汀二甲双胍片(Ⅱ)的生产申请,2018年10月正式纳入优先审评,历时7百多天获国家药监局批准生产,并视同通过一致性评价,为该品种首家。
- 2018年9月,杭州中美华东制药提交西格列汀二甲双胍片(Ⅰ)的上市申请,在2020年12月获批生产,并通过一致性评价。
- 2019年4月,通化东宝药业提交其4类仿制药西格列汀二甲双胍片(Ⅱ)的上市申请,历时九百多天获批,并视同通过一致性评价。
图4:“西格列汀二甲双胍片”的一致性审评信息
数据来源:药融云中国药品审评数据库
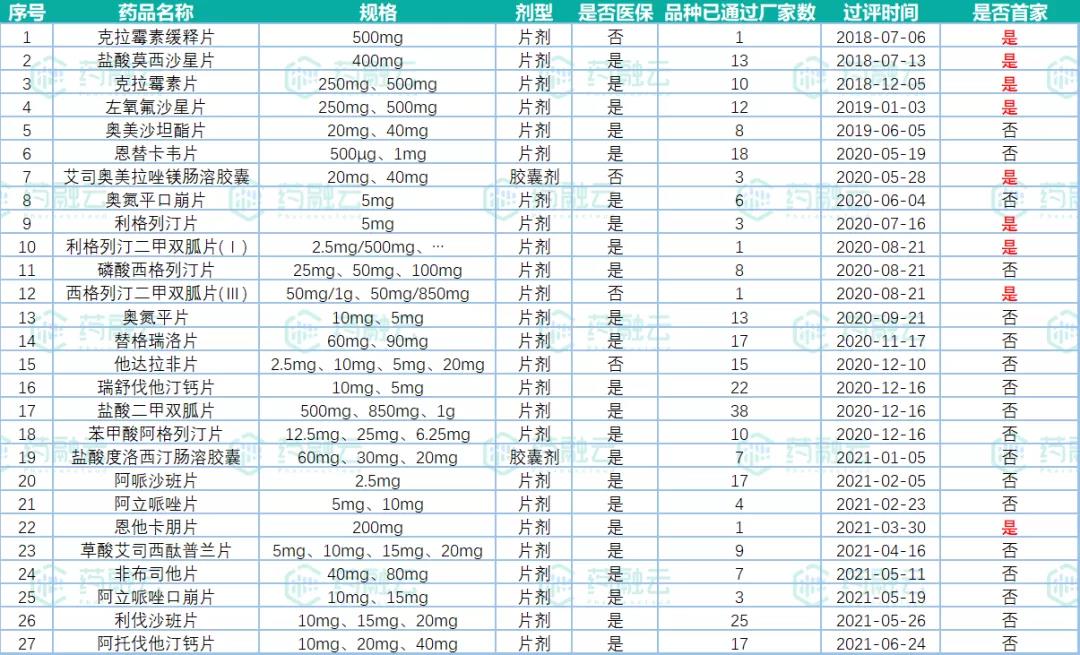
广东东阳光药业过评药品超20品种,累计9款首家
根据药融云数据库显示,截止目前广东东阳光药业有限公司已有59个品规通过(含视同通过)一致性评价,其中包括克拉霉素缓释片、盐酸莫西沙星片、克拉霉素片、左氧氟沙星片、艾司奥美拉唑镁肠溶胶囊、利格列汀片、恩他卡朋片等9个首家品种。广东东阳光药业过评的药品均按照新注册分类获批后视同通过一致性评价。
表1:“广东东阳光药业”过评药品汇总
数据来源:药融云一致性评价数据库
—END—

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论