
11月16日,亚盛医药(6855.HK)宣布,公司自主研发的新型选择性Bcl-2抑制剂APG-2575(拟定中文通用名:力胜克拉片)的新药上市申请(NDA)已获国家药品监督管理局(NMPA)药品审评中心(CDE)受理,并被推荐纳入优先审评程序,用于治疗难治或复发性(r/r)慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)。
这是首个在国内提交NDA的国产原研Bcl-2抑制剂,有望成为全球第二个上市的Bcl-2抑制剂。
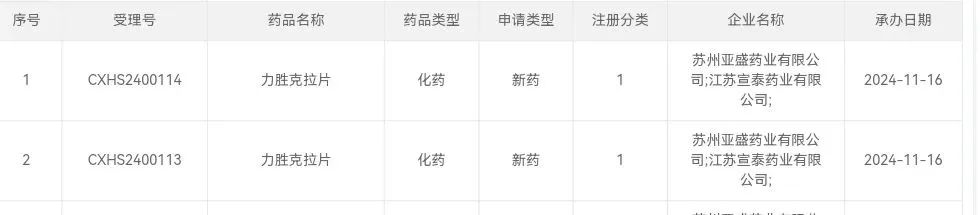
截图来自:CDE官网
此次提交的NDA是基于一项在中国开展的关键注册II期临床研究(APG2575CC201)结果。该研究旨在评估APG-2575单药治疗r/r CLL/SLL患者的有效性和安全性,该研究的主要终点指标为总缓解率(ORR)。
Bcl-2抑制剂的出现让CLL/SLL的治疗有了进一步的革新。Bcl-2是一种凋亡抑制因子,可以控制线粒体膜通透性来调节细胞存活,通过抑制线粒体细胞色素C的释放,或者结合凋亡激活因子,来抑制凋亡蛋白酶的活性。Bcl-2在许多恶性血液肿瘤特别是CLL/SLL中过度表达,是肿瘤细胞逃避凋亡的重要机制之一。
然而Bcl-2靶点成药性难度很高,主要是因为其作用机制是蛋白-蛋白相互作用 (Protein-protein Interaction, PPI),靶点结合界面比较大,很难设计小分子去抑制并发挥阻断作用。此外,Bcl-2靶点位于线粒体膜上,线粒体是双膜结构,属于细胞中结构最复杂、最难的部分之一,药物需要先通过细胞膜进入细胞后才能进一步作用于线粒体膜上,这无疑更加大成药难度。
靶点发现至今近40年,全球只有一款靶向Bcl-2的抑制剂获批上市,充分展现了该领域的研发难度与挑战。国外CLL/SLL治疗已进入了“无化疗”、“固定疗程”的新时代,而此前该治疗领域尚未有任何一款Bcl-2抑制剂在中国获批,因此国内也急需新的治疗选择。
2023 年 ASH 年会上,亚盛曾公布了力胜克拉对接受过大量治疗的 CLL 患者的最新疗效和安全性结果。该结果包含两项 Ib/II 期研究(NCT03913949 和 NCT04494503)的 14 个月随访的最新数据。
截至 2023 年 4 月 27 日,共有 47 名 CLL 患者入组。其中,44.7% 的患者接受过 ≥3 线治疗;66.0% 的患者接受过 ≥2 线治疗;23.4% 的患者既往接受过 BTK抑制剂治疗;55.3% 的患者既往接受过 CD20 单抗治疗。
疗效结果显示:
CLL 患者的 ORR 为 73.3%(33/45),CR/CRi 率为 24.4%(11/45),且 CR/CRi 率随剂量增加呈上升趋势。
外周血 MRD 检测患者中,38.9%(7/18)达到 MRD 阴性状态。通过骨髓 MRD 检测患者中,66.7%(4/6)为 MRD 阴性。
首次缓解中位时间为 2.07 个月,中位 PFS 为 18.53 个月,30 个月 OS 率为 86.3%,意味着力胜克拉具有为 CLL 患者带来长期生存获益的潜力。
此外,APG-2575 也在 R/R CLL 患者中表现出了良好的安全性和耐受性。
BCL-2 是血液肿瘤领域的热门靶点。Insight 数据库显示,除了维奈克拉和力胜克拉之外,国内还有十多款在研项目进入临床阶段,竞争最激烈的适应症领域是 CLL/SLL、AML。国内 Bcl-2 抑制剂适应症分布(仅共计临床及以上阶段项目)

截图来源:Insight 数据库
其中,在 CLL/SLL 适应症领域,国内尚无 BCL-2 抑制剂获批,亚盛的力胜克拉是首个提交该适应症 NDA 的 BCL-2 抑制剂。这意味着,国产 BCL-2 抑制剂有望赶超外企,抢先在国内拿下 CLL/SLL 适应症。
关于亚盛医药
亚盛医药是一家综合性的全球生物医药企业,致力于研发创新药,以解决肿瘤等领域全球患者尚未满足的临床需求。2019年10月28日,公司在香港联交所主板挂牌上市,股票代码:6855.HK。
亚盛医药已建立丰富的创新药产品管线,包括抑制Bcl-2、IAP 或 MDM2-p53 等细胞凋亡通路关键蛋白的抑制剂;新一代针对癌症治疗中出现的激酶突变体的抑制剂等,为全球唯一在细胞凋亡通路关键蛋白领域均有临床开发品种的创新公司。目前公司已在中国、美国、澳大利亚及欧洲开展40多项临床试验,其中包括13项注册临床研究(已完成/进行中/拟启动)。
用于治疗慢性髓细胞白血病的核心品种耐立克®曾获中国国家药品监督管理局新药审评中心(CDE)纳入优先审评和突破性治疗品种,并已在中国获批,是公司的首个上市品种。
目前,耐立克®已被成功纳入《国家基本医疗保险、工伤保险和生育保险药品目录》。该品种还获得了美国FDA快速通道资格、孤儿药资格认定以及欧盟孤儿药资格认定。
来源 | 倚锋资本





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论