2024年11月5日,聚焦于基因和细胞治疗的上海邦耀生物科技有限公司(以下简称“邦耀生物”)宣布,其基于具有自主知识产权的非病毒定点整合CAR-T平台开发的名为“靶向CD19非病毒 PD1定点整合 CAR-T 细胞注射液”(管线代号:BRL-203)的临床试验申请(IND),正式取得中国国家药品监督管理局药品审评中心(CDE)的批准。该项IND针对的适应症为“中度或重度难治性系统性红斑狼疮(SLE)”,这是邦耀生物在治疗自身免疫性疾病领域开发的创新型CAR-T产品,也是世界首个治疗自免疾病并获批IND的非病毒定点整合PD1-CAR-T产品,为自免疾病的治疗提供了多元化的选择。值得一提的是,邦耀生物非病毒定点整合PD1-CAR-T疗法(管线代号:BRL-201)此前在治疗复发或难治性B细胞非霍奇金淋巴瘤(r/r NHL)中展示了优异的临床安全性与有效性,相关研究成果发表在国际顶级学术期刊Nature上,并被评为“2022年中国血液学十大研究进展”和“中国2022年度重要医学进展”。
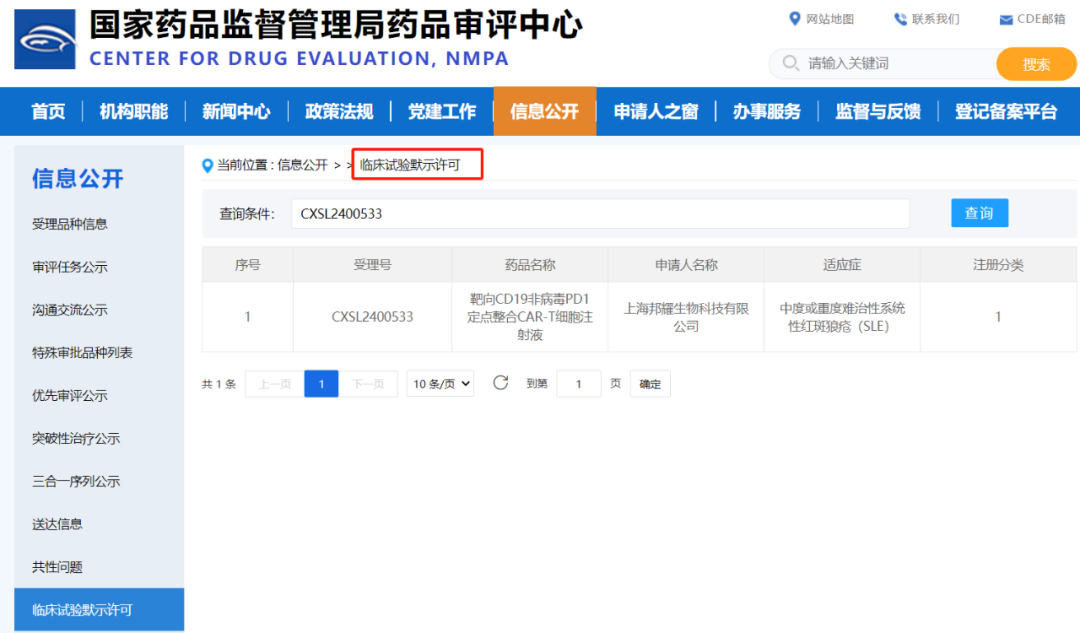
CDE官网获批截图
CAR-T疗法成为治疗自免疾病的“新选择”
系统性红斑狼疮(SLE)是一种严重的自身免疫性疾病,近年来,尽管SLE患者的长期生存有所改善,但不可避免的疾病复发及其导致的不可逆的器官损伤仍是患者死亡的重要原因,他们的死亡率是普通人群的3-4倍。最近,接连有红斑狼疮患者新闻引发社会关注与讨论:一位名叫“沙白白”来自上海患有SLE的女生因不愿忍受终身透析的痛苦,决意去瑞士接受安乐死“体面”地离开世界;2023年12月,知名香港女演员周海媚也是因罹患红斑狼疮离世,使“不死的癌症”进入大众视野。接连引起热议,反映了当下红斑狼疮患者生存的艰难与无助,因此,急需新型治疗手段实现病症的持续缓解,控制器官损伤,改善患者长期生存,甚至实现彻底治愈。
自身免疫性疾病是一组异质性疾病,共同的疾病基础是免疫耐受受损。目前临床上常使用免疫抑制剂来治疗自身免疫性疾病,但存在治疗周期长、易复发,感染及肿瘤的风险增加,及部分患者不能耐受或疗效不佳的情况。靶向B细胞单克隆抗体提供了新的治疗选择,但依然存在停药后复发、感染及部分患者疗效不佳等问题。鉴于B细胞在自身免疫性疾病中的重要作用,国内外已有不少团队尝试将CAR-T疗法应用于自身免疫性疾病,在包括系统性红斑狼疮、特发性炎性肌病、系统性硬化症以及重症肌无力等自免疾病的治疗中已展现出优异的临床效果。
邦耀生物非病毒定点整合PD1-CAR-T治疗自免疾病更安全、更有效、更可及!
然而,无论是针对肿瘤还是自免疾病适应症,已上市或在研产品仍集中于采用病毒载体制备的自体CAR-T产品,不可避免存在潜在的致瘤风险、产品制备时间长可及性低、以及生产成本高等问题与挑战。尤其FDA针对已上市的病毒载体CAR-T产品陆续要求“黑框警告”,于2024年4月18日,FDA正式宣布要求接受已上市CAR-T产品治疗的患者和临床试验参与者还应该“终身”跟踪继发性T细胞癌症的潜在发展情况。此外,国家药监局也于2024年2月7日回应称,考虑到嵌合抗原受体(CAR)-T细胞免疫治疗产品(简称“CAR-T产品”)的特性,我国在批准四个CAR-T产品上市时,也已要求在说明书的“注意事项”中提示使用本品治疗后,存在发生继发性恶性肿瘤的可能性,并提示患者需终身监测继发性恶性肿瘤。那么,可见在CAR-T针对自免适应症的治疗中也将会要求的更加严格。
相较而言,邦耀生物利用具有自主知识产权的非病毒定点整合CAR-T平台(Quikin CART)开发的靶向CD19非病毒PD1-CAR-T产品“BRL-203”则能够解决现有病毒CAR-T存在的痛点,展现出了巨大的优势:更安全、更有效、更可及。
产品优势:
制备快成本低,患者更可及
保证产品均一性,临床更安全
非病毒定点整合技术可以让每个CAR序列都精确地插入到基因组的特定位点,能避免随机插入导致的致瘤风险,最大程度保证了CAR-T产品的安全性和有效性。利用该项创新型技术在前期开展的BRL-201治疗复发/难治性非霍奇金淋巴瘤临床试验中,21例患者接受治疗后,未观察到CAR-T治疗相关的神经毒性和2级以上细胞因子风暴,证明了非病毒定点整合PD1-CAR-T疗法极具出色的临床安全性。
打破复发难治枷锁,治疗更有效
此外,通过已有的BRL-201临床研究结果显示,患者客观缓解率(ORR)高达100%,完全缓解率(CR)达到85.7%,且患者长期获益显著高于现有同类病毒CAR-T产品,截止2024年2月10日,中位总生存(mOS)达到39个月,中位无进展生存期(mPFS)达到了20个月,是迄今为止全球CAR-T细胞治疗难治复发淋巴瘤中高缓解率和低毒副反应的最好临床结果。单细胞测序结果表明,BRL-201细胞产品中存在高比例的记忆性T细胞且具有更强的抗肿瘤免疫功能,回输后的CAR-T细胞具有长期存续的能力。可见,证明了非病毒定点整合PD1-CAR-T疗法具有出色的临床有效性,在自身免疫性疾病的治疗中也将展示长期效益,惠及患者。

E.N.D

声明:内容来源于公司官方,本文旨在知识共享,所有内容仅供参考,不构成任何建议。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论