2024年8月19日,第一三共宣布,其创新性的HER-2 ADC药物Enhertu,在美国获得针对 HER2 低或 HER2 超低转移性乳腺癌患者的突破性治疗认定,这也是Enhertu获得得第八项FDA突破性治疗认定。

转移性激素受体阳性 HER2 低(IHC 1+ 或 IHC 2+/ISH-)或 HER2 超低(IHC >0 <1+)乳腺癌患者,这些患者通常一线内分泌治疗联合 CDK4/6 抑制剂治疗,六个月内或在开始辅助内分泌治疗后 24 个月内出现病情进展,急需要后线药物的治疗。

FDA 授予Enhertu此项 BTD 是基于DESTINY-Breast06第 3 阶段试验的数据,该试验在 2024 年美国临床肿瘤学会 (#ASCO24) 年会上作为最新口头报告进行展示。

HER2-low人群中,Enhertu经确认的ORR达到56.5%,其中9例完全缓解(CR)和194例部分缓解(PR)。而TPC组经确认的ORR为32.2%,且无CR患者,仅有114例患者PR。
HER2-ultralow人群中,Enhertu经确认的ORR高达61.8%,是TPC组(26.3%)的2倍多。

HER2-low人群中,Enhertu显著降低疾病进展或死亡风险达38%,中位PFS达到13.2个月,而TPC组仅为8.1个月,改善绝对值为5.1个月(HR 0.62;95% CI:0.51-0.74;P<0.0001)。OS已显示出获益趋势,Enhertu组和TPC组的12个月OS率为87.6% vs 81.7%。
HER2-ultralow人群中,PFS获益与HER2-low人群一致,Enhertu组中位PFS也为13.2个月,TPC组为8.3个月,改善绝对值为4.9个月(HR 0.78;95% CI:0.50-1.21)。OS数据尚不成熟,T-DXd和TPC组12个月OS率分别是84.0%和78.7%。
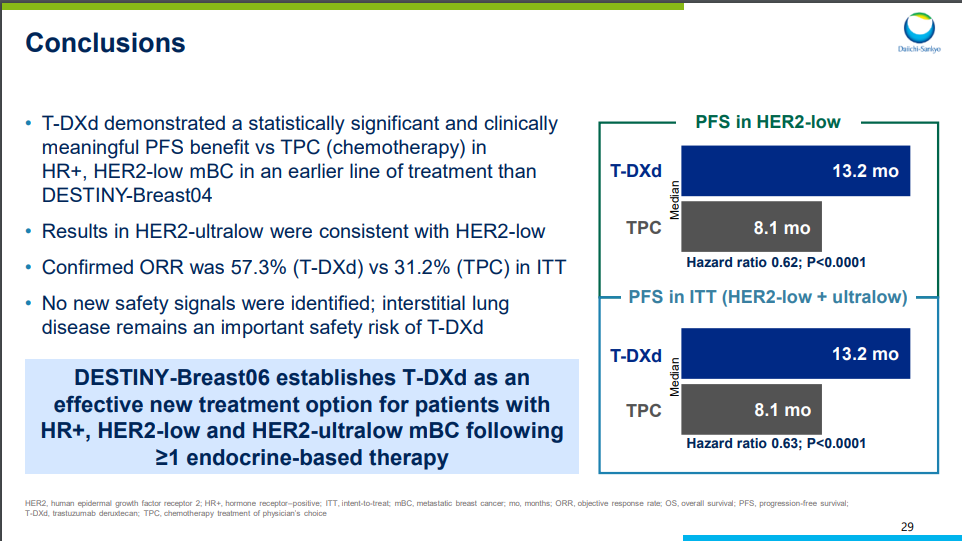
此前,根据DESTINY-Breast04试验数据,Enhertu已经在转移性乳腺癌化疗后HER2 超低表达患者的治疗获得批准,希望此次基于DESTINY-Breast06试验数据和突破疗法认定,Enhertu能够为转移性激素受体阳性 HER2 低或 HER2 超低患者带来福音。
目前Enhertu已经在乳腺癌、肺癌、胃癌和HER2阳性泛癌种等5个适应症中获批,目前销售额也在进一步放量(爬升乏力:DS-8201半年销售额达到17.72亿美金),希望其能够取得更多突破。

ADC Academy Online
ADC Academy Online是聚焦于抗体偶联药物的学术交流平台。平台紧跟相关领域的最新进展,致力于促进相关专业人士的科学交流和继续医学教育。




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论