
在即将到来的10月,将有4款重磅药物有望获得批准,其中包括:Zealand公司胰高血糖素类似物Dasiglucagon、BMS重磅PD-1抑制剂O药新辅助疗法、Camurus公司罕见病疗法Oclaiz以及Iterum Therapeutics公司在研口服碳青霉烯类抗感染药物:
1. Zealand:Dasiglucagon
PDUFA日期:2024年10月8日
Dasiglucagon是Zealand公司开发的一款胰高血糖素类似物,它具有独特的稳定性,可以在水溶液的状态下稳定存在。2021年,Dasiglucagon以商品名Zegalogue在美国上市,用于治疗6岁及以上糖尿病成人和儿童的严重低血糖,这是该药物获批的首个适应症,Zegalogue是第一个也是唯一一个用于治疗6岁及以上儿童和成人糖尿病患者严重低血糖的胰高血糖素类似物。Zealand公司同时开发了名为HypoPal的自动注射器,它可以由糖尿病患者自己操作,快速治疗严重低血糖。

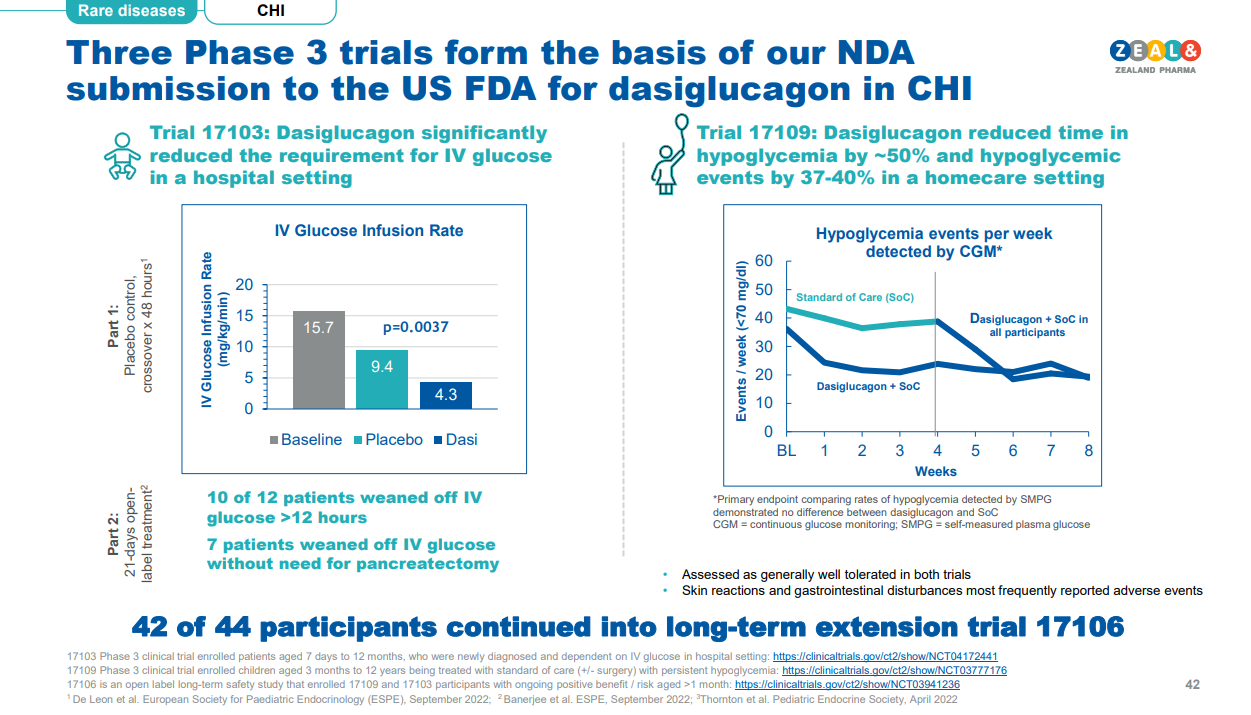
两项三期试验(NCT04172441;NCT03777176)和一项正在进行的长期扩展试验(NCT03941236)的数据为该NDA提供了支持。FDA正在对同一NDA进行两部分审查。第1部分涉及Dasiglucagon用于预防和治疗出生7天及以上的先天性高胰岛素血症(CHI)儿童患者的低血糖症,用药时间最长为3周,预计将于10月8日做出决定。第2部分涉及该药物3周以上的使用,为支持第2部分的审查,美国FDA要求对现有的连续血糖监测 (CGM) 数据集进行额外分析,这些数据集被列为第3阶段计划的次要结果指标。提交NDA第2部分的时间将推迟到2024年下半年。
2. BMS:Opdivo
PDUFA日期:2024年10月8日
FDA正在审查BMS重磅PD-1抑制剂Opdivo(nivolumab)与化疗联用作为新辅助疗法用于IIA至IIIB期可切除非小细胞肺癌(NSCLC)患者围手术期治疗的sBLA,PDUFA日期定为2024年10月8日。
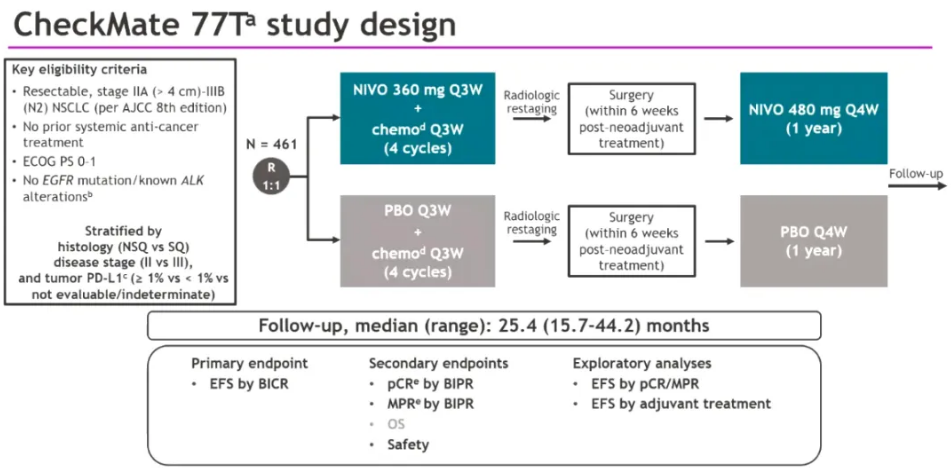
该申请得到了一项III期随机、双盲、安慰剂对照、多中心研究CheckMate-77T(NCT04025879)研究数据的支持。 该研究在461名IIA至IIIB期可切除NSCLC患者中评估了新辅助nivolumab联合化疗,序贯手术和nivolumab辅助治疗,对比新辅助化疗联合安慰剂,序贯手术和安慰剂辅助治疗的疗效与安全性。该研究的主要终点是无事件生存期(EFS)。次要终点包括病理完全缓解(pCR)、主要病理缓解(MPR)、总生存期(OS)和安全性。
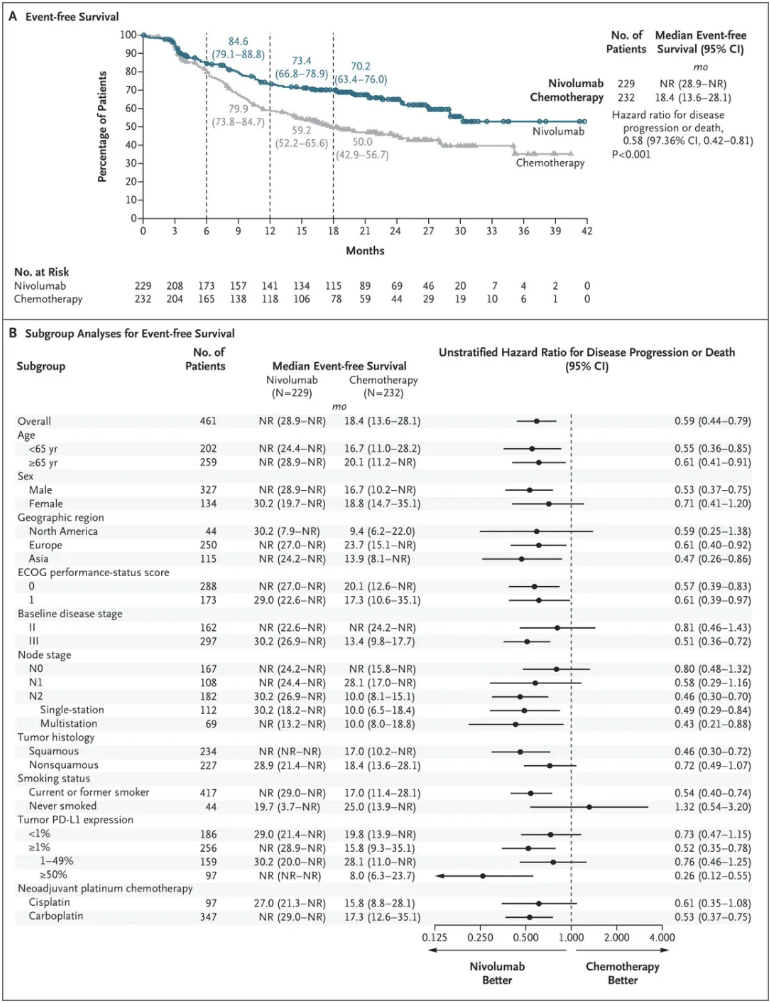
中位随访25.4个月,NIVO组和化疗组的18个月EFS率为70.2% vs 50.0%(HR=0.58,P<0.001),NIVO组可降低42%的疾病进展或复发、取消手术或死亡风险。研究者评估的EFS观察到相似的获益(HR=0.56)。亚组分析结果中,PD-L1高表达患者有更高的EFS获益。NIVO组和对照组pCR率分别为25.3% vs 4.7%(HR,6.64;95% CI,3.40-12.97);MPR率分别为35.4% vs. 12.1%(HR,4.01;95% CI,2.48-6.49)。
3. Camurus:Oclaiz (CAM2029)
PDUFA日期:2024年10月21日
2024年3月5日,Camurus公司宣布美国FDA已经受理了该公司用于治疗肢端肥大症患者的Oclaiz(CAM2029)的新药申请(NDA),PDUFA日期为2024年10月21日。CAM2029是一种新型的奥曲肽皮下注射剂,设计方便,每月一次自行给药,提高了奥曲肽的血浆暴露,并能有效控制疾病。
该NDA得到了7项临床研究数据的支持,其中包括两项3期研究(ACROINNOVA 1 [NCT04076462]和ACROINNOVA 2[ NCT04125836])。
ACROINNOVA 1是一项为期24周的随机、双盲、安慰剂对照研究,共纳入了72名接受标准疗法稳定治疗的肢端肥大症成年患者。研究结果显示,72.2%接受Oclaiz治疗的患者有生化反应,而接受安慰剂治疗的患者只有37.5%(主要终点为第22周和第24周平均胰岛素样生长因子[IGF-1]≤正常值上限[ULN];P=0.0018)。
ACROINNOVA 2研究对Oclaiz的长期安全性进行了评估,该研究纳入了135名成年肢端肥大症患者。在这项为期52周的研究中,Oclaiz 的安全性与第一代体生长抑素受体配体一致。此外,在整个研究人群中还观察到生化应答率(IGF-1≤1xULN)显著增加。
4. Iterum:sulopenem etzadroxil/probenecid
PDUFA日期:2024年10月25日
2024年5月31日,Iterum Therapeutics宣布美国FDA已确认收到重新提交的sulopenem etzadroxil/probenecid(舒洛培南口服制剂)新药申请(NDA),用于治疗成年女性无并发症尿路感染(uUTI),PDUFA日期定为2024年10月25日。

sulopenem etzadroxil是一种在研的口服碳青霉烯类抗感染药,已与probenecid合制成双层片剂。重新提交的文件包括REASSURE[NCT05584657](Sulopenem用于耐药肠杆菌科的uUTI的重新评估),SURE (Sulopenem用于耐药肠杆菌科)1,SURE 2和SURE 3的3期临床试验的数据,其中口服Sulopenem耐受性良好,未发现安全性问题。
REASSURE试验比较了口服Sulopenem和口服Augmentin®对患有尿路感染的成年女性的疗效。结果表明,口服Sulopenem在主要疗效终点(即对 Augmentin®易感致病菌患者的临床和微生物反应)上不劣于Augmentin®(61.7% vs 55%),总体成功率的差异表明口服Sulopenem在统计学上显著优于Augmentin®。SURE 1 临床试验对患有 uUTI 的成年女性进行了口服Sulopenem和口服环丙沙星的比较,结果表明,对于喹诺酮类非敏感病原体患者,在治愈测试访视中的临床和微生物学反应的主要疗效终点方面,口服Sulopenem比广泛使用的对照药环丙沙星具有统计学优势。
参考资料:各公司官网
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论