一、改良型新药
1.1 与新分子实体相比,改良型新药具备研发经济优越性
新分子实体和生物创新药、仿制药研发投入对比

与新化学实体和创新生物药相比,改良型新药的研发时间约短67%,研发成功率提高约23%,因此研发成本也大幅降低。
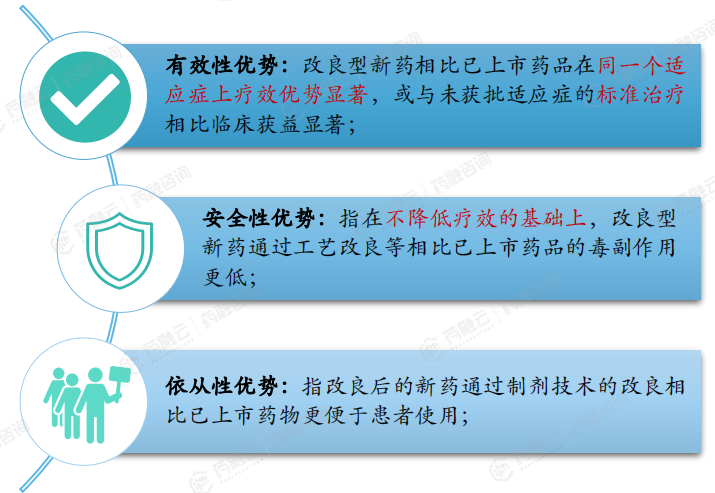
在临床要求上,通过改良其结构、配方及工艺、给药途径及适应证,使其有效性、临床优势、安全性及患者依从性通常更佳,因此具有较大优势。
1.2 强调临床价值的要求,是中国化药改良型新药审批的主旋律
化学药品改良型新药注册分类:
2.1类:含有用拆分或者合成等方法制得的已知活性成份的光学异构体,或者对已知活性成份成酯,或者对已知活性成份成盐(包括含有氢键或配位键的盐),或者改变已知盐类活性成份的酸根、碱基或金属元素,或者形成其他非共价键衍生物(如络合物、螯合物或包合物),且具有明显临床优势的原料药及其制剂。
2.2类:含有已知活性成份的新剂型(包括新的给药系统)、新处方工艺、新给药途径,且具有明显临床优势的制剂。
2.3类:含有已知活性成份的新复方制剂,且具有明显临床优势。
2.4类:含有已知活性成份的新适应症的制剂。
明显的临床优势
1.3 改良型新药市场分析
中国改良型新药市场规模(单位:亿人民币)
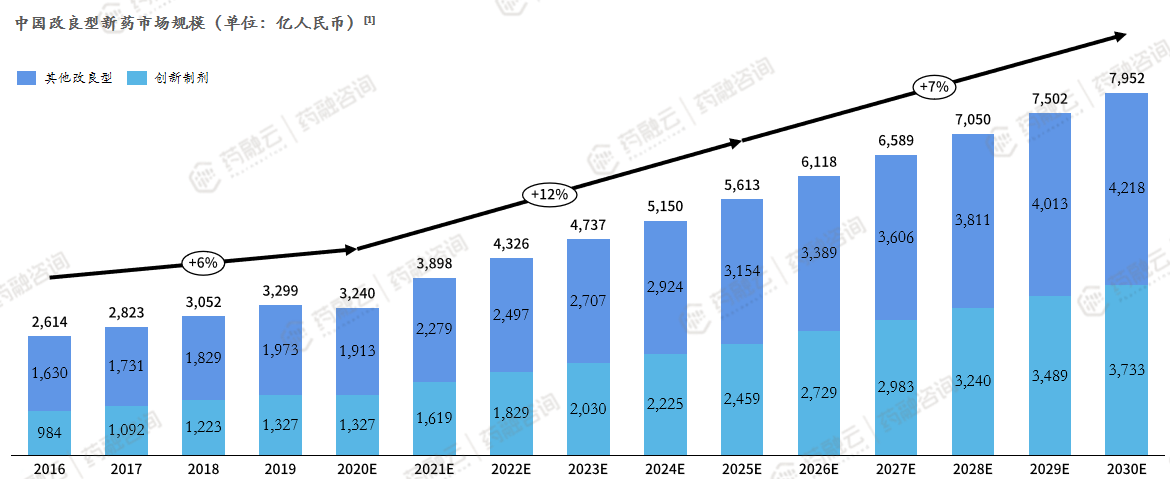
中国改良型新药市场规模将持续稳定地增长。预计2023年,中国改良型新药市场规模将达4737亿人民币,其中创新制剂是改良型新药的中流砥柱。
1.4 改良型新药重点分析
2.2类与2.4类新药是改良型新药的重点,剂型方面注射剂、片剂备受关注。
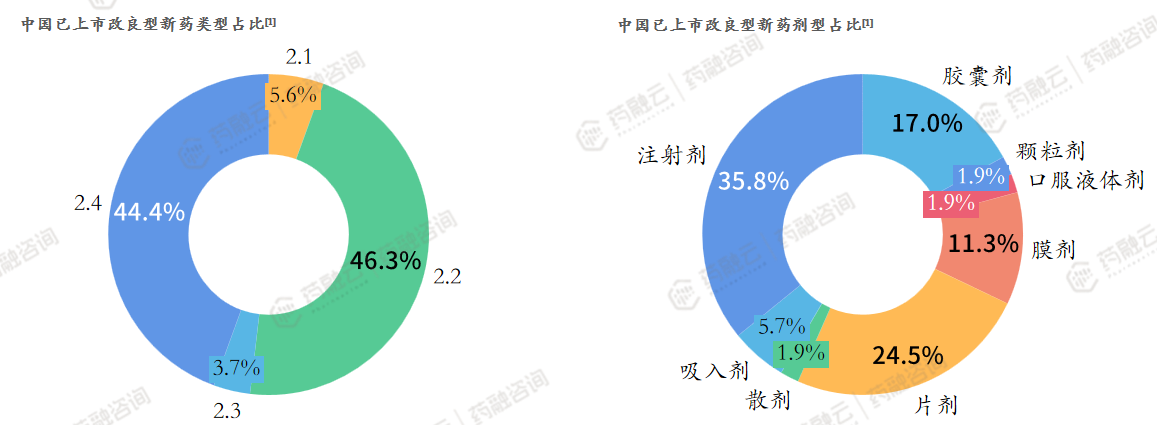
数据来源:药融云数据库
(截止至2023年9月,同一药物有多种注册类型的按多个计算)
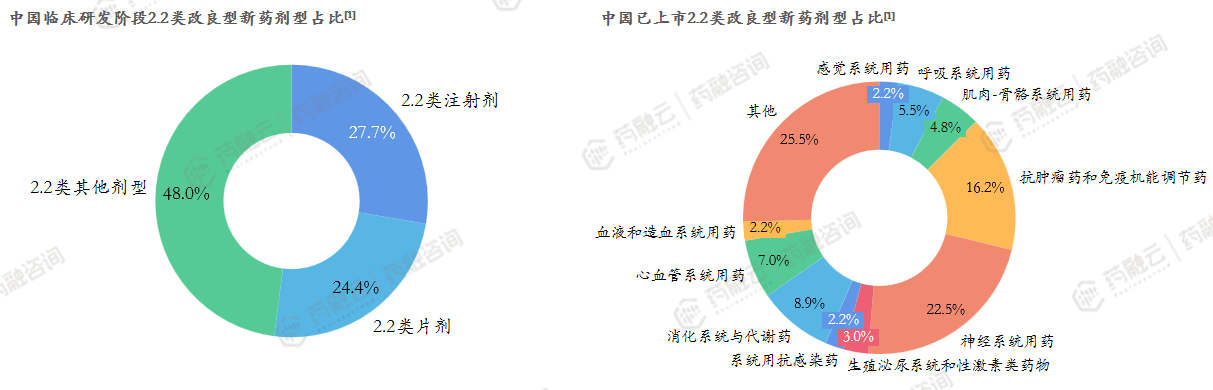
从药品类型看:中国已上市改良型新药以2.2类、2.4类为主;从剂型方面看:中国已上市改良型新药以注射剂、片剂、胶囊剂、膜剂为主。
2.2类新药是改良型新药的研发重点。
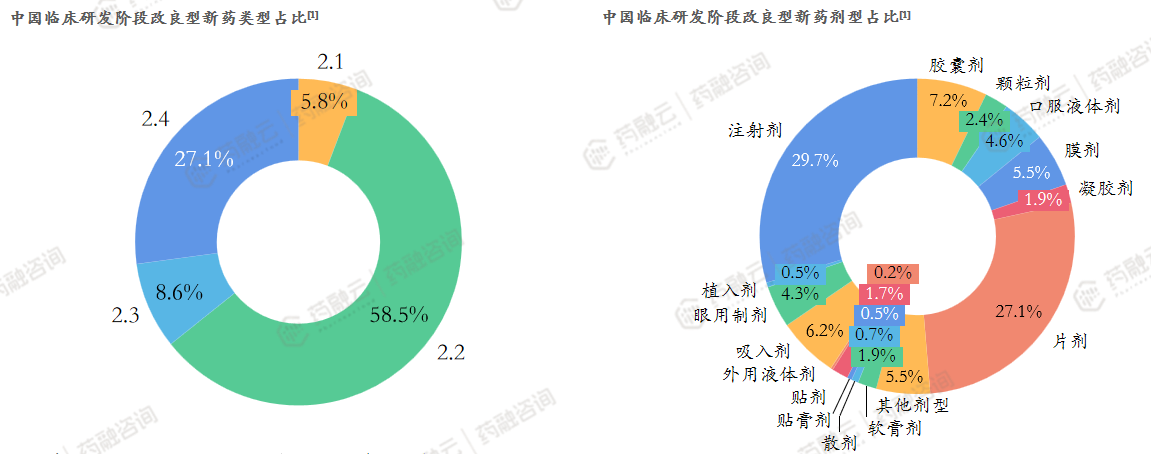
从药品类型看:中国处于临床研发阶段的改良型新药以2.2类为主;从剂型方面看:中国处于临床研发阶段的改良型新药剂型种类较多,但仍以注射剂、片剂为主。
2.2类改良注射剂是企业改良型新药立项/研发的重点。
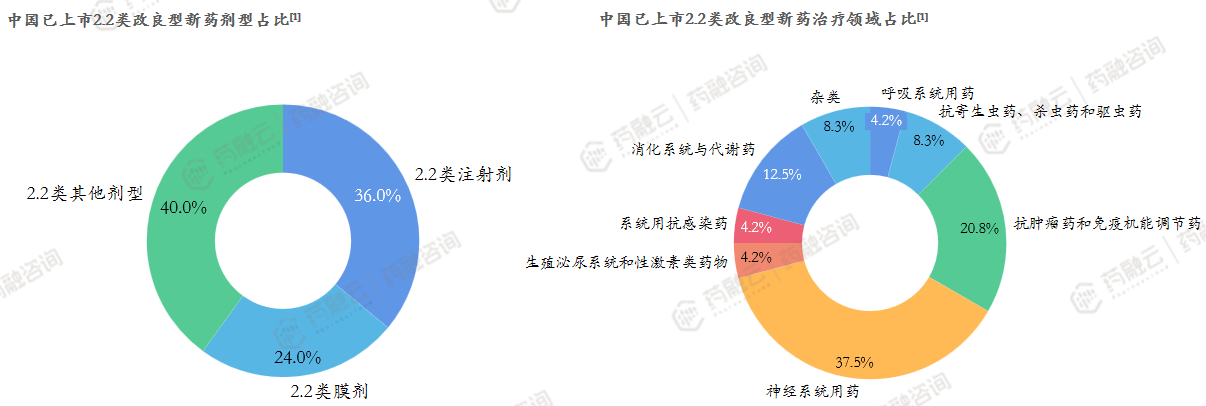
截至2023年9月,NMPA批准25个2.2类改良型新药,主要围绕奥氮平、孟鲁司特、恩替卡韦、紫杉醇、利培酮等大品种做剂型改良。从剂型上看,以注射剂、口溶膜为主。改良注射剂,特别是创新注射剂型是企业改良型新药立项/研发的重点,由于口溶膜仅需完成BE实验,研发周期较短同样受到企业青睐。从治疗领域来看,主要集中在神经系统相关疾病、肿瘤疾病领域,这主要是由于神经疾病、肿瘤患者对于用药的依从性和安全性要求更高,更易接受改良型新药。
从治疗领域看:2.2类改良型新药主要集中在神经系统相关疾病、肿瘤疾病领域。神经系统药物占比最大,适应症主要为镇痛、镇静、帕金森等疾病。这主要是由于神经疾病、肿瘤患者对于用药的依从性和安全性要求更高,更易接受改良型新药。从剂型方面看:以注射剂、缓释片、口溶膜为主。
二、复杂注射剂
2.1 复杂(特殊)注射制剂的定义及分类
注射为临床常用的给药方式之一,相关药物递送平台(特殊注射剂)的开发也是近年来的热点。目前特殊注射剂无官方明确定义,通常认为特殊注射剂包括脂质体、微球、胶束、微晶、原位凝胶等,其活性成分在体内行为受制剂技术的影响较大,并能达到如高靶向性、高载荷、低毒副作用等效果。

2.2 脂质体的定义及分类
脂质体结构最初由英国血液学家AlecDBangham于1961年描述。首次作为药物载体是20世纪90年代初期。
从结构上看,脂质体是由膜状脂质双分子层包围着水体积的同心漂流囊泡。双层脂膜通常由磷脂组成,磷脂含有疏水的尾部和亲水的头部。通过调整加入脂质种类可以调整脂质体的性能。脂质体可装载亲水性药物于内部水环境中,也可将疏水性药物嵌入脂质膜之间或吸附在脂质体表面。
脂质体分类标准众多,包括结构特征、结构参数和尺寸、合成方法、组成成分和载药量等。

根据脂质体粒径的大小和脂质双层膜数量,可以将脂质体分为:单层脂质体(ULVs)、寡层脂质体(OLVs)、多层脂质体(MLVs)、多囊脂质体(MVLs)。
2.3 脂质体作为药物递送载体的临床应用
脂质体作为基于胆固醇和天然无毒磷脂的球形囊泡,因其生物相容性、适当的尺寸以及其具有可载药的疏水层和亲水层等特性,目前已被认为是高度通用的纳米颗粒,可用于生物医学中多个领域,特别是对于药物递送。
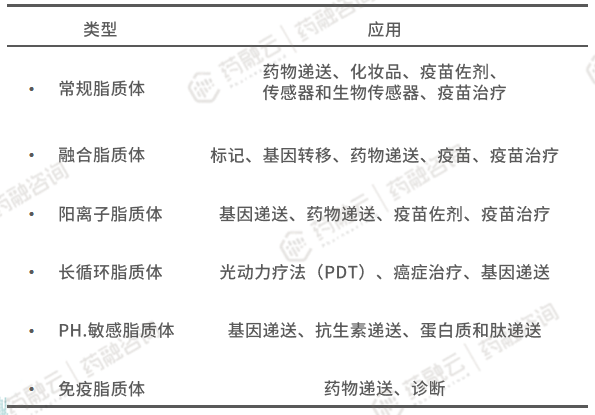
递送抗肿瘤药物是脂质体最被人熟知的运用之一。通过主动靶向策略(基于肿瘤组织生理特点)和被动靶向策略(基于脂质体膜表面修饰),脂质体可将药物靶向递送至肿瘤组织中。
2.4 脂质体作为药物递送载体的优缺点
脂质体的优势:
基于脂质体特殊的结构,其有许多有独特的优势。(1)可装载水溶性和脂溶性药物,脂质体作为两亲性和非离子结构颗粒,为递送水溶性和脂溶性药物提供了绝佳的机会。(2)结构框架可调节,通过调整脂质体所含脂质可控制脂质体的渗透性、刚性、尺寸。(3)膜表面可修饰,通过将抗体等分子修饰在脂质体表面,可提高靶向、长循环等性能。
脂质体的劣势:
脂质体的结构仍存在一些限制,阻碍了其广泛的临床应用。最重要的障碍归因于它们的物理和化学稳定性。(1)水溶液中溶解性低;(2)部分脂质体体内环境半衰期短;(3)生产成本高;(4)脂质体体积较大增加靶向难度;(5)装载药物的渗漏和融合;(6)磷脂氧化和水解;(7)快速被RES系统识别;(8)某些过敏反应。
2.5 中国对脂质体的监管现状——非临床药代动力学研究指导原则
脂质体药物非临床药代动力学研究的一般原则可参照已发布的相关技术指导原则,如ICHS3A、S3B、M3(R2)等。
具有纳米药物属性的脂质体药物的非临床药代动力学研究可参照《纳米药物非临床药代动力学研究技术指导原则(试行)》。
2023年10月,药品审批中心发布了《脂质体药物非临床药代动力学研究指导原则》,对脂质体药物需要特殊关注的内容提出要求。主要适用于化学药物脂质体产品的非临床药代动力学研究,包括创新药、改良型新药和仿制药。单抗、多肽或小分子等配体修饰形成的主动靶向脂质体药物以及环境响应类脂质体药物情况复杂,指导原则中不包括此类脂质体药物的非临床药代动力学研究具体要求,但整体思路和部分共性的非临床药代动力学研究可借鉴该指导原则,并根据品种具体特点进行相应的非临床药代动力学研究。
整体考虑
在开展脂质体药物的非临床药代动力学研究时,应注意比较其与对应的普通药物制剂在药代动力学特征上的异同。一般而言,脂质体药物的药代动力学特征可能取决于:
(1)包封活性成分的脂质体药物自身的清除
(2)包封的活性成分自脂质体中的释放速率
(3)未包封活性成分的清除和代谢
(4)脂质体药物的分布(器官和/或组织分布的变化以及分布的活性成分的量)
(5)脂质体或活性成分与血浆或血清蛋白、血细胞或血管内皮的相互作用等
2.6 中国对脂质体的监管现状——质量控制研究技术指导原则
脂质体药物质量控制研究中涉及的一般性要求可参照已发布的相关技术指导原则。
具有纳米药物属性的脂质体药物的质量控制研究可参照《纳米药物质量控制研究技术指导原则(试行)》。
2023年10月,药品审批中心发布了《脂质体药物质量控制研究技术指导原则》。指导原则主要适用于化学药物脂质体产品的质量研究和质量控制,包括创新药、改良型新药和仿制药。另外,部分脂质体仿制药可参考个药指南(如适用)。该指导原则暂不包括单抗、多肽或小分子等配体修饰形成的主动靶向脂质体药物以及环境响应类脂质体药物,但整体思路和部分共性的质量研究可借鉴该指导原则。
整体思路
脂质体药物质量控制的整体思路是基于药物评价的风险评估策略和从研发、生产到使用的全过程质量控制策略。
基于风险评估的质量控制研究应关注脂质体药物的质量特性对药物的安全性和有效性的影响,重点包括以下几方面:
(1)脂质体药物的类型、剂型、给药途径、临床应用方式和治疗目的等;
(2)脂质体药物的组成、结构形态和完整性;
(3)脂质体药物的粒径及其分布、表面电荷、包封率和相变温度;
(4)脂质体药物的释药行为;
(5)脂质体药物特殊的表面性质;
(6)脂质体药物的稳定性;
(7)脂质体药物表征方法的准确性和适用性。
2.7 美国对脂质体的监管现状——FDA行业指导
美国食品药品监督管理局发布的《LiposomeDrugProducts:Chemistry,Manufacturing,andControls;HumanPharmacokineticsandBioavailability;andLabelingDocumentation》中讨论了申请人应在药物评价与研究中心(CDER)审查的脂质体药物产品的新药申请(NDA)或简略新药申请(ANDA)中提交哪些类型的信息。该指南没有针对根据生物制品许可申请(BLA)上市的脂质体药物产品提出具体建议,但本指南中描述的许多科学原则可能也适用于这些产品。讨论涉及脂质体药物产品的以下主题:
(1)化学、制造和控制(CMC):描述和组成;物理化学性质;关键质量属性;制造过程和过程控制的描述;脂质成分的控制;药品规格;稳定性;制造批准后的变更。
(2)人体药代动力学:生物利用度和生物等效性。临床药理学研究;生物药剂学。
(3)标签

三、已上市脂质体注射剂分析
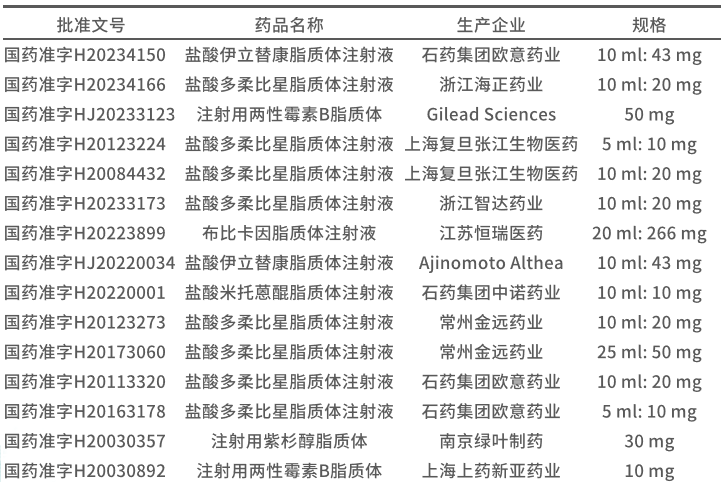
3.1 中国上市脂质体注射剂药物批文情况
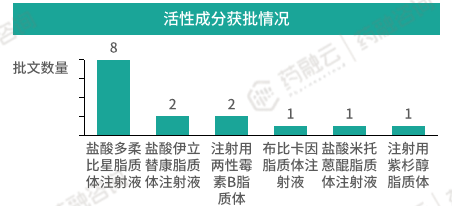
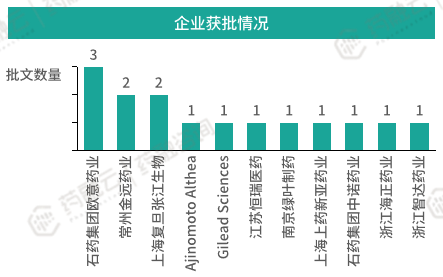
根据药融云数据库,目前我国在使用状态的脂质体注射剂批文共有15条。对应6个活性成分,其中盐酸多柔比星脂质体获批批文最多,共有八条,分别来自于浙江海正药业、上海复旦张江生物医药、浙江智达药业、常州金远药业、石药集团欧意药业等5家制药企业。
3.2 中国上市脂质体注射剂药物市场情况
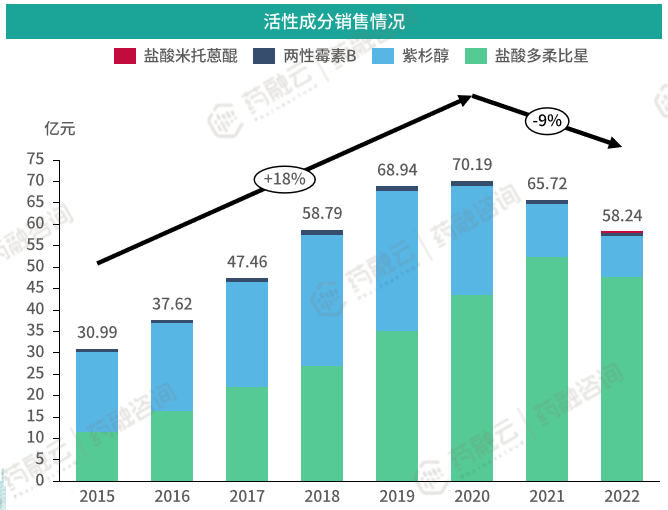
根据药融云数据库,截至2022年,有相关销售信息的活性物质共有4个,分别为盐酸多柔比星、盐酸米托蒽醌、两性霉素B及紫杉醇。2015-2020年间,我国脂质体市场保持快速增长,年复合增长率为18%;2020年后销售额逐年降低。目前市场主要由盐酸多柔比星及紫杉醇占据,为抗肿瘤药。石药集团近年在我国脂质体市场中份额来增长迅速,至2022年,其约占一半我国脂质体市场份额。
3.3 海外上市脂质体注射剂药物情况
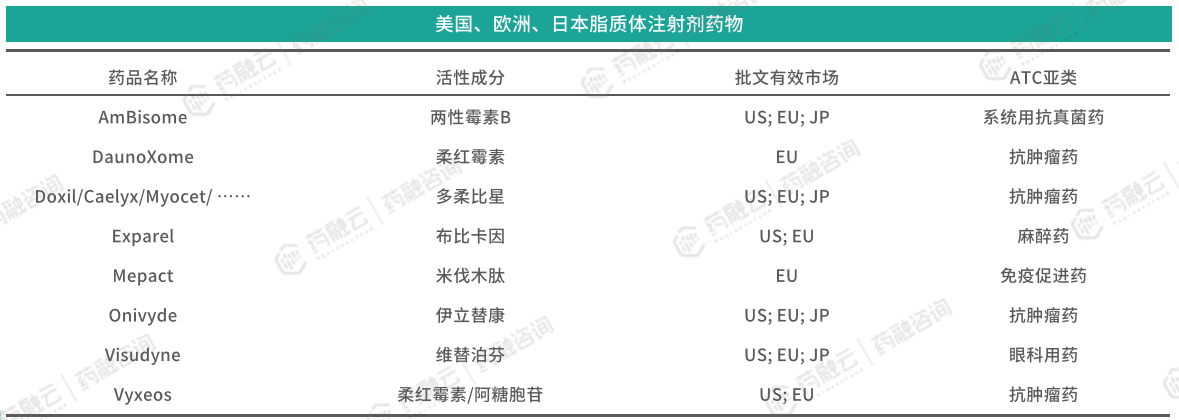
目前在美国、欧盟、日本获批上市的脂质体药物注射剂有8种活性成分(组合)。治疗方向除国内常见的抗肿瘤、抗真菌外,还有麻醉、免疫促进、眼科用药等方向。
3.4 经典改良型脂质体注射剂分析—多柔比星
改良成脂质体的必要性:
(1)多柔比星细胞周期非特异性药物→直接作用于DNA,抑制DNA合成,干扰RNA转录,以此抑制肿瘤细胞→但该方式不能选择性区分肿瘤和正常细胞,且通过半醌代谢物损害心肌细胞→带来严重剂量依赖性以及心脏毒性.
(2)PEG化脂质体能够免遭单核巨噬细胞系统(MPS)鉴别和清除→增加药物在血液循环系统中的保留时间,利用肿瘤的EPR效应,以自身长循环特性增加药物在肿瘤部位的蓄积,使肿瘤组织内药物浓度超出正常组织药物浓度20倍,部分甚至达到60倍→实现被动靶向肿瘤的目的。
(3)显著增强抗肿瘤活性的同时也大大降低了对正常组织的毒性,包括心脏毒性、脱发及骨髓抑制。
已上市脂质体:DOXIL/Caelyx(长循环)、Myocet(非PEG化)、Lipo-dox

Doxil VS Myocet:与Doxil相比,Myocet进入体内后的循环时间较短、释放速度较快。但Myocet的包装中分为三个小瓶,临床使用前,将空白脂质体混悬液注射到碳酸钠缓冲液中,脂质体外水相的pH值调节至7~8,再与DOX的生理盐水溶液混合。使用较麻烦。
Lipo-dox是Doxil的仿制药,活性成分、剂型、给药途径均一致,辅料添加了少数无水乙醇,并以DSPC取代了原研中的HSPC。
国内上市情况:2003年,强生旗下西安杨森将盐酸多柔比星脂质体注射液(商品名为楷莱/Caelyx)引入中国市场,2015年注册证号到期后未进行再注册。在此期间,中国市场上相继出现三家仿制药,分别为上海复旦张江的“里葆多”(2008)、石药欧意的“多美素”(2011)以及常州金远的“立幸”(2012)。
3.4 经典改良型脂质体注射剂分析—布比卡因
适应症:手术部位切口的局部浸润麻醉(2011年);通过肌间沟臂丛神经阻滞给药以产生手术后局部镇痛(2018年)。
处方:13.3mg/mL布比卡因、8.2mg/mLDEPC,0.9mg/mLDPPG,2.0mg/mL三辛酸甘油酯,4.7mg/mL胆固醇。
体外释放数据:4h时释放度25%,24h释放度51%,48h释放度68%,72h释放度87%。镇痛起效时间:大约为30min。
制剂特征:Exparel采用DepoFoam®多囊脂质体技术,每一个微小囊泡都由许多含有布比卡因的含水腔室及隔开腔室的类脂双分子层构成。每个腔室与相邻的腔室通过磷脂膜分隔开,中性磷脂则填充在腔室的交汇处,起到稳定结构的作用。布比卡因多囊脂质体内部含有大量的水相,粒径在24 ~ 31μm,分散悬浮在0.9%氯化钠溶液中,具有包封率高、包封体积大和渗漏率小等特点。
生产工艺:复乳法。生产过程:初乳—复乳—初有机溶剂—外水相置换(超滤)——含量浓缩。工艺难点:采用复乳法制备技术—两次乳化增加了工艺难度,对工艺参数的控制更加严格—容易导致产品批间差异大。多囊脂质体的平均粒径为几十微米—因此无法过滤除菌,而特殊脂质体剂型也让其无法终端灭菌—只能选择生产过程全程无菌,但过于耗时的工艺会增加无菌控制的难度,对生产环境的要求较高。
布比卡因普通注射剂改良成脂质体的优势
(1)延长镇痛时间,降低给药频率:①相比于普通注射剂5~6h的作用时间,布比卡因脂质体制剂将镇痛效果延长到72h,更有利于手术患者的疼痛管理。②临床上一些镇痛药物多需要配合镇痛泵或配静脉留置针(频繁给药)使用,而长效布比卡因脂质体能够降低给药频率,减轻患者痛苦。
(2)降低患者对阿片类药物的依赖:临床镇痛治疗中常采用不同作用机制的镇痛药物联合/交替使用,阿片类药物存在呼吸抑制、成瘾等严重副作用,在临床中EXPAREL表现出优异的疼痛管理,并有效降低患者对阿片类镇痛药物依赖性。
(3)降低药物副作用:布比卡因脂质体局部注射后缓慢释放药物,减少药物的迅速扩散和吸收入血,降低毒副作用的产生。

尽管局麻市场体量不大,但在进口替代背景下,加上仿制药价格优势,国产有望抢占原研市场具有一定仿制门槛,毛利相对较高,拓展适应症潜力大,国内手术患者基数大,目前市场玩家相对较少。
3.5 国内已上市2.2类脂质体品种分析—盐酸米托蒽醌脂质体注射液
获批企业:石药中诺
适应症:既往至少经过一线标准治疗的复发或难治外周T细胞淋巴瘤(PTCL)成年患者
药理作用:盐酸米托蒽醌脂质体注射液的活性成分为米托蒽醌。米托蒽醌的主要作用机制为通过氢键结合插入DNA,引起DNA结构的交联和断裂;能够干扰RNA,同时也是具有解旋和修复受损DNA作用的拓扑异构酶Ⅱ的有效抑制剂,其对体外培养的增殖性和非增殖性人类细胞均有杀伤作用,为细胞周期非特异性药物。
技术改良点:盐酸米托蒽醌脂质体,其粒径约30‑80nm,含有:1) 活性成分米托蒽醌,与脂质体内的多价反离子形成难以溶解的沉淀;2)磷脂双分子层含有相转变温度(Tm)高于体温的磷脂,从而使脂质体的相转变温度高于体温。
(1)经脂质体包裹后,改变了米托蒽醌在体内的药代动力学特征和组织分布。该脂质体具有的60 nm粒径使其不易透过正常血管间隙,能够被动靶向肿瘤部位;
(2)其表面经甲氧基聚乙二醇修饰,使其免受网状内皮系统识别,延长血液循环时间;
(3)其在血液中包封稳定,游离药物占总药量比例恒定在1%左右,使药物在到达肿瘤组织前保持脂质体完整性,不产生药理、毒理活性;
(4)ABC转运蛋白的药物外排作用具ATP依赖性,减少米托蒽醌外排,保证胞内药物浓度,增强抗肿瘤活性。
制备工艺流程
(1)空白脂质体形成:氢化大豆卵磷脂、胆固醇和聚乙二醇2000修饰的二硬脂酰磷脂酰乙醇胺按3:1:1质量比溶解于95%乙醇为油相,300mM硫酸铵为水相,混合制备多室脂质体。
(2)降低脂质体粒度:微射流均质工艺降低粒度并检测。
(3)制造梯度:超滤去除外相硫酸铵,建立跨膜硫酸铵梯度。
(4)主动载药包封:按照脂药比16:1比例加入米托蒽醌,60-65℃进行载药,凝胶排阻色谱证明包封效率。
盐酸米托蒽醌脂质体注射液 VS 普通盐酸米托蒽醌注射液改良后优势

(1)脂质体安全框更宽
盐酸米托蒽醌注射液:按体表面积12~14mg/m2,每3~4周一次
盐酸米托蒽醌脂质体注射液:按体表面积20mg/m2,每4周一次
(2)脂质体游离药物少,半衰期长
盐酸米托蒽醌注射液:半衰期T1/2为40~120小时,游离药物比例高
盐酸米托蒽醌脂质体注射液:半衰期T1/2为67.69~84 小时,游离与总量药物浓度比值在0.50%~2.00%
(3)安全性高
盐酸米托蒽醌注射液:静脉毒性试验死亡剂量0.9mg/kg
盐酸米托蒽醌脂质体注射液:静脉毒性试验死亡剂量3.0mg/kg
(4)临床安全性好
盐酸米托蒽醌注射液:心脏相关的TEAE发生率高(33.3%);肌钙蛋白T升高发生率高(36.7%)不良反应更多
盐酸米托蒽醌脂质体注射液:心脏相关的TEAE发生率低(26.7%);肌钙蛋白T升高发生率低(3.3%);心律失常不良事件也更低
总结:本品剂量相对于普通制剂提高了将近 50%,血液学毒性两者较接近,心脏 毒性降低,其它器官系统的不良反应发生率亦降低。相当于本品的指数提高,安全窗变大。
盐酸米托蒽醌脂质体注射液市场信息
盐酸米托蒽醌脂质体注射液 —2022年1月上市,中位定价6988元,2022年销售额约0.17亿元;盐酸米托蒽醌脂质体注射液上市2年后将纳入医保,2023年国家医保谈判成功,降价60.07%, 价格降至2790元。
3.6 国内已上市其他脂质体品种分析
(1)注射用紫杉醇脂质体

适应症:曾用过含阿霉素标准化疗的乳腺癌患者的后续治疗或复发患者的治疗;卵巢癌的一线化疗及以后卵巢转移性癌的治疗;非小细胞肺癌患者的一线化疗。
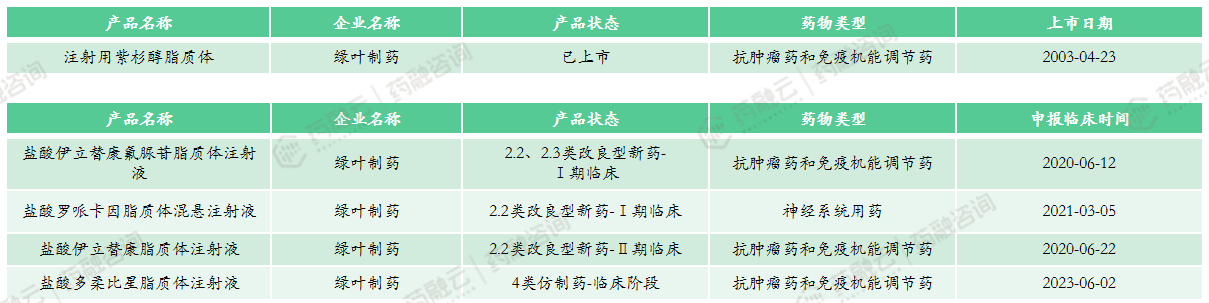
市场竞争情况:注射用紫杉醇脂质体(商品名:力扑素®),由我国绿叶制药自主研发,是全球唯一上市的紫杉醇脂质体制剂,目前仍处于活跃状态脂质体注射液中最早上市的产品。
目前已纳入医保目录,采购价为228元。同品种无竞争压力,但面临着同类药的竞争压力,其市场规模受医保降价问题、注射用紫杉醇(白蛋白结合型)仿制药集采的严重冲击呈下降趋势。
(2)盐酸多柔比星脂质体注射液
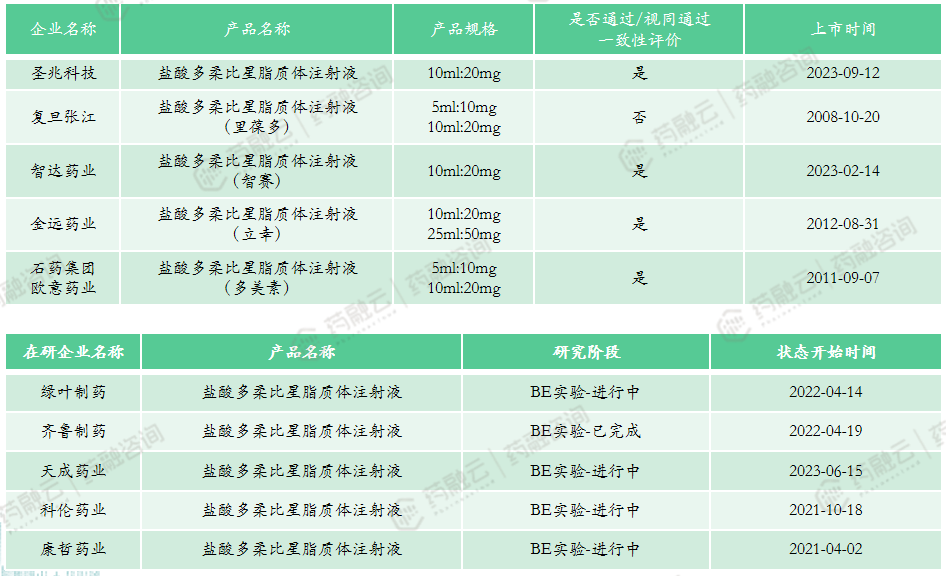
申报类型:3类仿制药
适应症:低CD4及有广泛皮肤粘膜内脏疾病的与艾滋病相关的卡波氏肉瘤(AIDS-KS)病人,或不能耐受下列两种以上药物联合化疗的病人。
原研上市时间:1995年11月-美国
市场竞争情况:进口产品均已退出中国市场。以10ml:20mg规格计算,2022年中位中标价为4577元;2022年全国医院端销售额47.66亿元,全国药店零售端销售额4.9亿元;本产品暂未纳入医保,4家企业通过一致性评价,多家企业进行/完成BE实验,未来集采可能性极高。
(3)盐酸伊立替康脂质体注射液
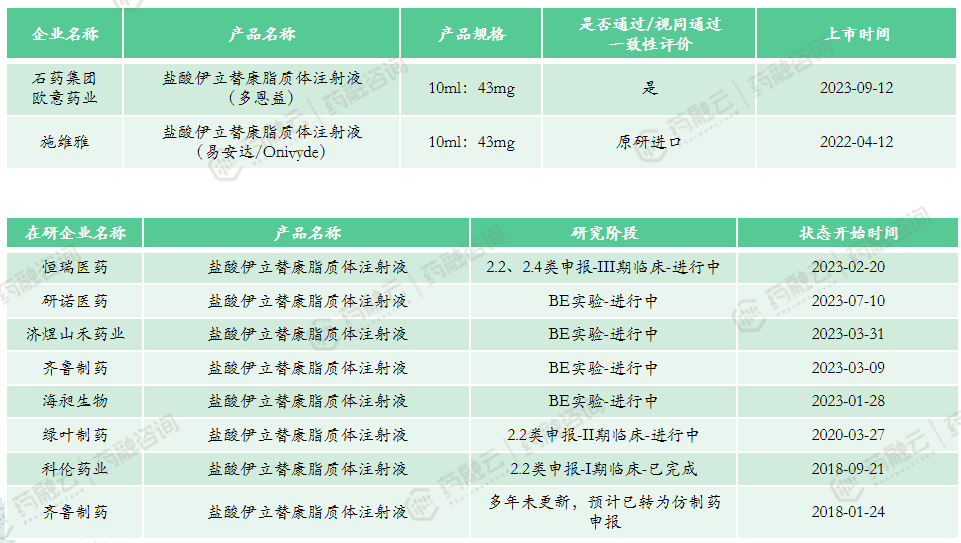
上市申报类型:4类、5.1类
适应症:胰腺癌
原研上市时间:2015年10月-美国
市场竞争情况:共计2款上市产品,国产产品与进口产品各1款,国产仿制已通过一致性评价。产品定价较高,2022年中标价为7794元,暂未纳入医保。上市时间较晚,市场竞争目前较低。多家企业申报该产品,其中恒瑞按2.2类、2.4类申报,希望将适应症拓展至其他实体瘤,目前进展较快,绿叶、齐鲁和科伦等临床进展不快。
(4)注射用两性霉素B脂质体
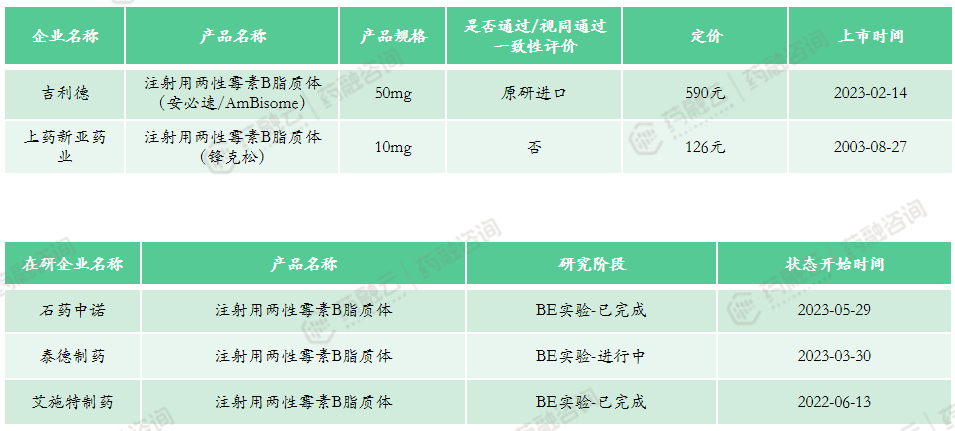
上市申报类型:原4类、5.1类
适应症:深部真菌感染、侵袭性真菌病(IFD)
原研上市时间:1990年12月-欧盟
市场竞争情况:共计2款上市产品,国产产品与进口产品各1款,医保乙类产品。2022年医院端销售额为7443万元,2022年药店零售端销售额为295万元。该产品市场规模不大,在研企业共3家,其中石药中诺、艾施特制药已完成BE实验。同款产品竞争较少,未来纳入集采可能性较低。
(5)布比卡因脂质体注射液
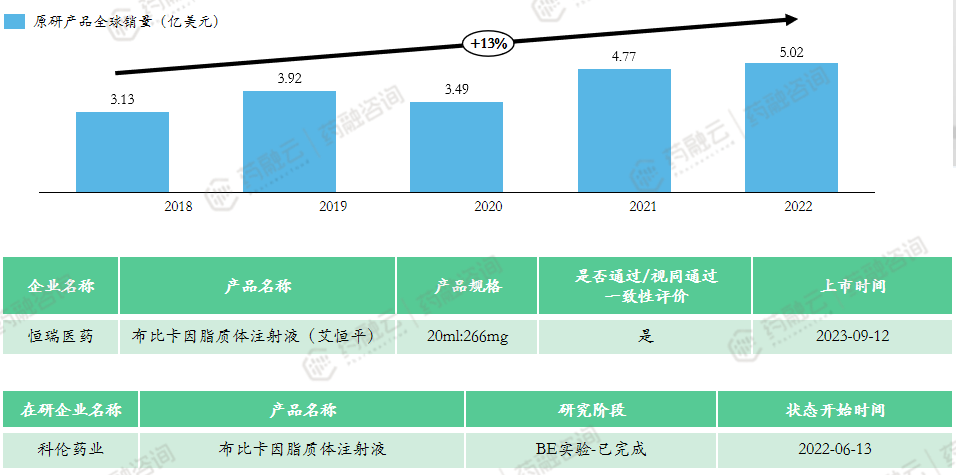
上市申报类型:3类
适应症:12岁及以上的患者单剂量浸润产生术后局部镇痛;成人肌间沟臂丛神经阻滞产生术后区域镇痛。
原研上市时间:2011年10月-美国
市场竞争情况:原研未进口,共计1款上市产品,恒瑞医药为全球首仿,已通过一致性评价。该产品2023年国家医保谈判成功,降价60.54%,2024年起定价382元。该产品技术流程中对无菌要求严格,门槛相对高,目前仅科伦1家企业布局该产品,未来市场竞争较小。
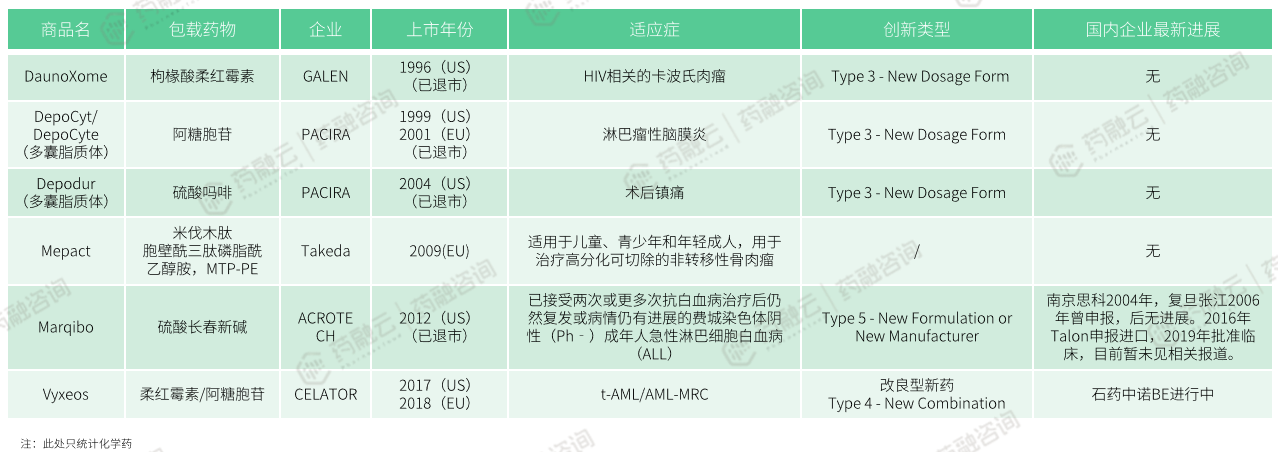
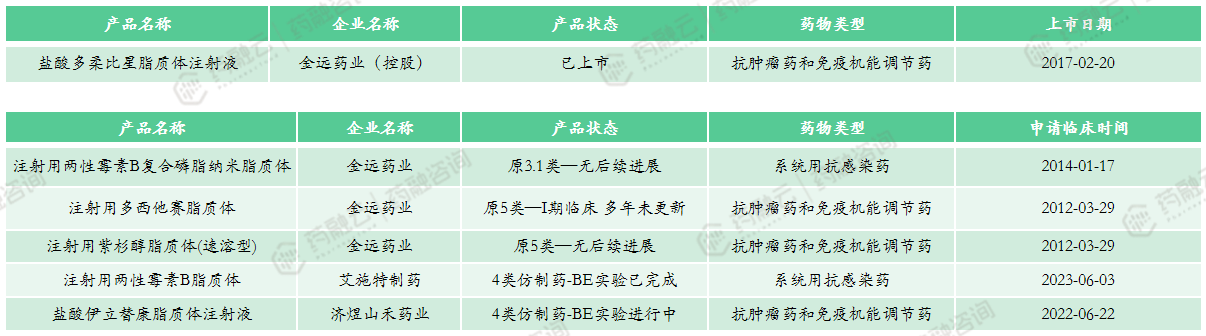
3.7 国际上已经上市但在中国尚未有仿制的产品
国外上市在国内未上市脂质体药物研发进展
四、在研改良型脂质体注射剂分析
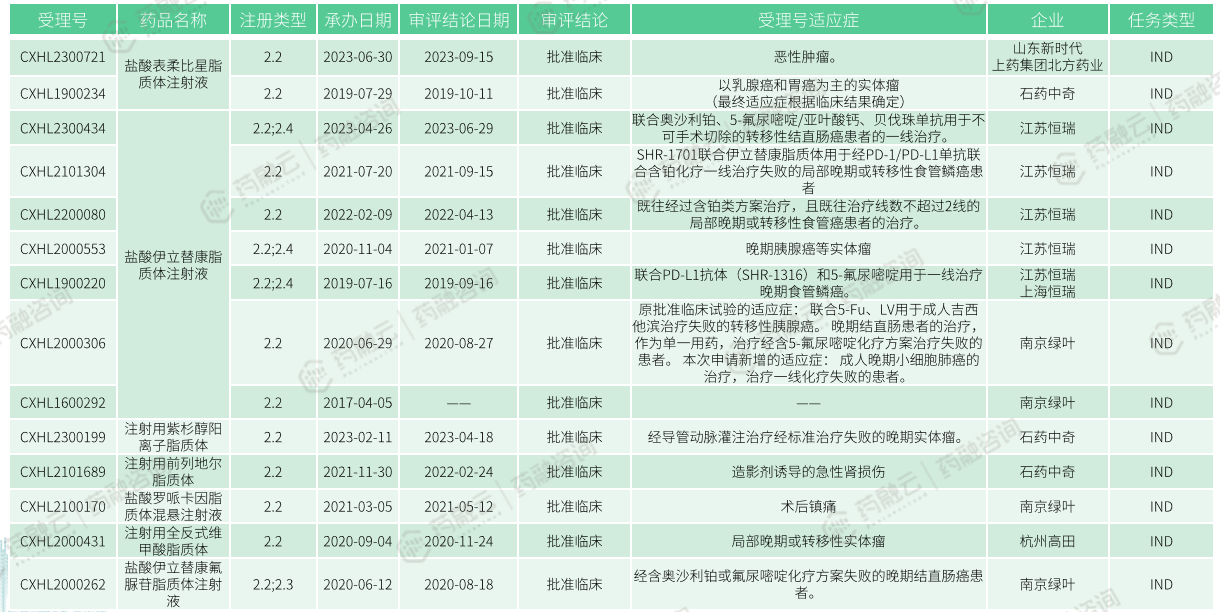
4.1 国内研发进展
改良型脂质体注射剂中国研究进展
4.2 临床阶段值得关注的改良品种分析
在研改良品种举例

4.3 临床阶段值得关注的改良品种分析
(1)前列地尔脂质体
药物名称:注射用前列地尔脂质体
企业:石药中奇
最新进展:2022-07-27:Ⅱ期进行中;2022-10-21第一例受试者入组
适应症:造影剂诱导的急性肾损伤
组成:前列地尔、蛋黄卵磷脂、麦芽糖和二丁基羟基甲苯,含有一定比例寡层脂质体,平均双层数量为1.3
粒径:80-200nm
已上市前列地尔特征及劣势
第一代:普通粉针,不具靶向性,极易在肺部被灭活,副反应大,注射后患者血管疼痛严重,伴严重消化道反应。
第二代:环糊精包合物,通过环糊精包裹可减少部分局部副反应,但依然不具靶向性,用药剂量大(100-200ug),到达病变部位有效成分少。
第三代:脂微球制剂,将前列地尔包封在油水界面处——避免在血液循环尤其是在肺部的失活——减少用药量(常用剂量:5、10ug),但仍存在一定刺激性,稳定性差,必须0-5摄氏度贮存,有效期12M,降解产物前列腺素A1限度高。
(2)甲磺酸艾立布林
艾立布林脂质体剂型(E7389-LF)的I期研究:晚期胃癌扩大队列的结果
主要研究结果:
• 共纳入34例既往至少接受过两次化疗的晚期胃癌患者,给予E7389-LF 2.0mg/m2 Q3W;
• 6例PR,ORR为17.6%,中位PFS为3.7个月,DCR为79.4%,CBR为32.4%;
• 治疗相关不良事件发生率为94.1%,≥3级为76.5%,最常见为中性粒细胞减少41.2%和白细胞减少29.4%;
• 8例接受内皮细胞/血管系统标志物检测,治疗后7例显著增加,无论最佳总体疗效如何,这些变化总体一致。
五、企业分析
5.1 国内脂质体注射剂企业分析
掌握相对成熟脂质体技术并有产品上市企业;具备脂质体技术并有多款产品在处于临床阶段企业具有脂质体技术储备企业,但数量较少/时间较远;无技术储备,主要从事进口药物引进;宣传公司具备脂质体技术平台,但暂无项目进入临床阶段。
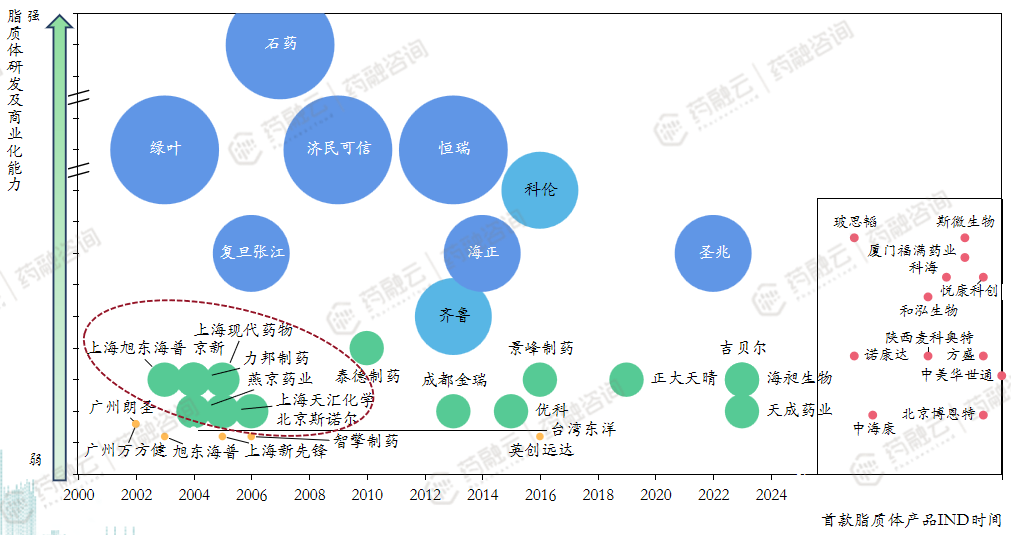
仅少数大型企业投入复杂制剂改良型新药研发,如石药、绿叶、恒瑞、科伦;其中石药、绿叶、恒瑞已经成功商业化项目;具备脂质体技术的企业目前以仿制药项目为主;国内大量具备脂质体技术的企业项目超10年无进展,其研发能力存疑。
近年来,脂质体注射剂仿制药的委托生产/联合研发需求逐渐提升;如圣兆药物委托海正药业生产盐酸多柔比星脂质体注射液、智达药业与恒瑞共同研发多柔比星脂质体注射液;脂质体注射液目前已并非行业热点,企业数量整体较少。
5.2 脂质体注射剂发展受限于辅料供应链
近年来,脂质体注射剂在医药领域取得了显著的进展,然而其发展却受制于国产辅料供应链的限制。部分原材料的依赖进口导致了生产成本的上升,使得脂质体注射剂面临着较大的成本压力。在这种情况下,能够自行生产脂质体关键辅料的企业就显得更具竞争优势,如石药、绿叶。
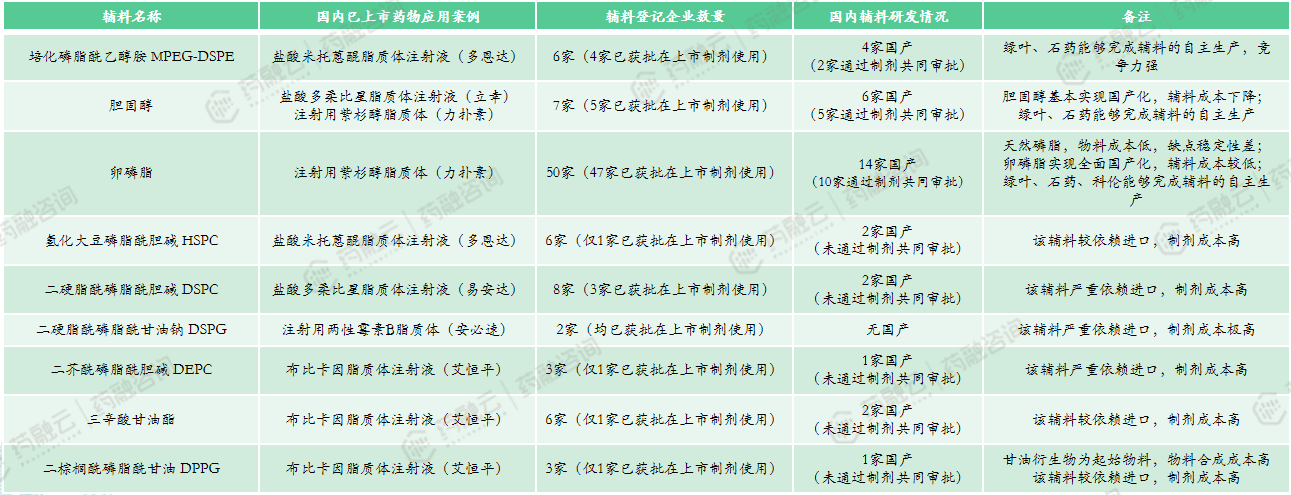
因此,加强国内脂质体注射剂关键辅料的生产能力,优化供应链,降低生产成本,是发展的关键挑战。通过技术创新,国内企业有望在这一领域取得更大的突破,推动脂质体注射剂行业朝着更加健康、可持续的方向发展。
5.3 国内主要改良型脂质体注射剂企业分析
(1)石药集团
石药集团纳米技术平台优势显著,已研发了包括纳米脂质体、白蛋白纳米制剂等多项核心递送技术,相关管线布局在国际上亦处领先地位。目前纳米脂质体主要由3家子公司负责研发生产:石药中诺、石药欧意、石药中奇;同时,石药具备部分核心脂质体辅料生产能力。
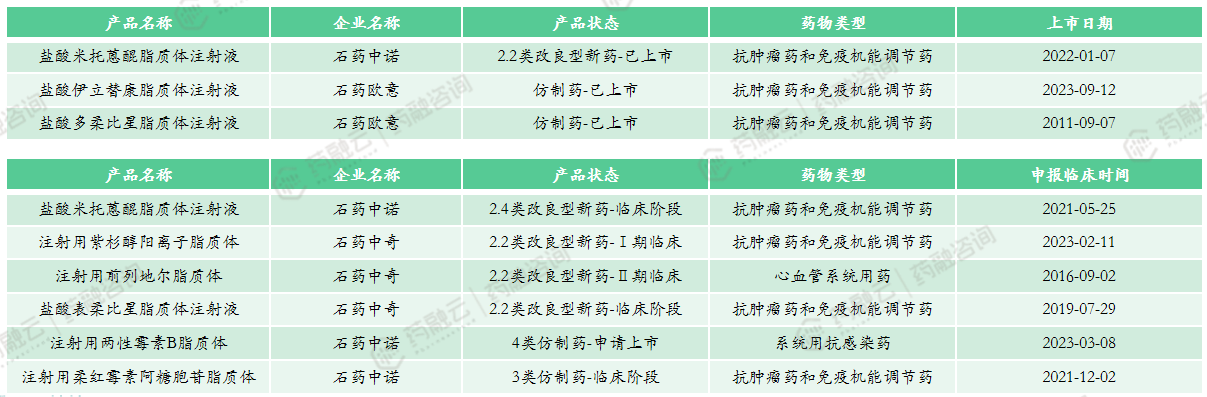
石药脂质体技术平台成功研发的产品均使用PEG化小单室的脂质体,采用刚性脂膜结构,利用主动载药的动力学梯度,让药物在脂质体里形成沉淀,从而持续有效且合理地释放药物,解决了开发上的难题,并保证了给药后纳米粒子可以有效地在肿瘤富集,提高安全性及有效性。
石药集团重点关注脂质体注射液,按石药集团计划,未来每一年都将有脂质体注射剂药品上市。
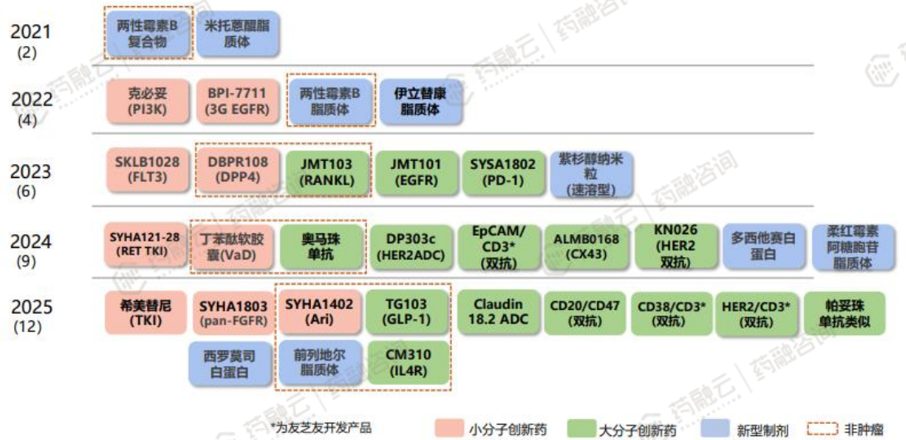
(2)绿叶制药
绿叶制药在微球、脂质体、透皮释药等先进药物递送技术领域达到国际先进水平,并在新分子实体、生物抗体、细胞、基因治疗等领域进行积极布局和开发。绿叶制药具备新型制剂&新分子实体(NME)技术平台,能够实现新型制剂如微球、脂质体、透皮释药技术产品的开发与商业化。同时,绿叶具备核心脂质体辅料生产能力。
绿叶集团的脂质体平台已经取得多项重要成果。注射用紫杉醇脂质体是目前全球首个及唯一获批上市的紫杉醇脂质体产品,上市20年以来销售额稳定,是公司的核心产品之一。此外,绿叶制药还开发了盐酸伊立替康和氟脲苷共同包载于脂质体创新制剂。值得一提的是,绿叶制药正在以多囊脂质体技术开发罗哌卡因脂质体混悬注射液,该创新制剂处于临床I期研究阶段。
(3)恒瑞医药
恒瑞医药具备深厚的脂质体注射液开发技术基础,尽管在研管线与上市产品数量较少,但在研/上市产品普遍技术难度较高。
恒瑞医药的布比卡因脂质体注射液采用多囊脂质体技术开发,是原研产品Exparel的全球首仿。除了原研厂家在DepoFoam技术平台上继续开发多囊脂质体产品外,几乎没有其他产品或者仿制药上市,深究原因,还是因其工艺复杂,很难达到同样的产品质量。
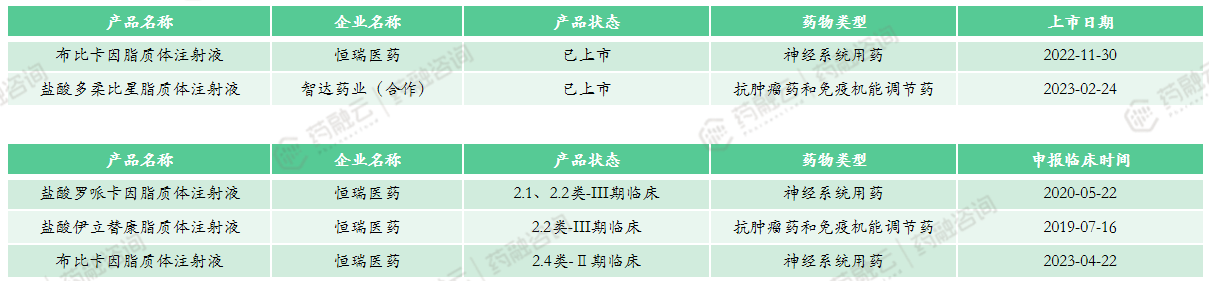
除自研管线外,恒瑞医药还与其他企业合作开发脂质体注射液产品,例如恒瑞医药与智达药业合作的智赛(盐酸多柔比星脂质体注射液)已通过一致性评价正式获批上市。
(4)济民可信
济民可信多家子公司/控股企业的脂质注射剂仿制药产品上市/进入临床阶段,目前暂未有2类新药处于临床阶段。
以上内容均来自{基于剂型改良的复杂注射剂分析——脂质体篇},如需查看或下载报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!




















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论