
在过去的几十年里,FDA通过包括加速审批在内的五种特殊指定和审查途径(孤儿药、快速通道、加速批准、优先审评和突破性疗法)来满足未被满足的医疗需求,旨在促进和加快针对严重疾病的药物开发。(相关阅读:HIV方向:一款AAV基因疗法获FDA“快速通道”)
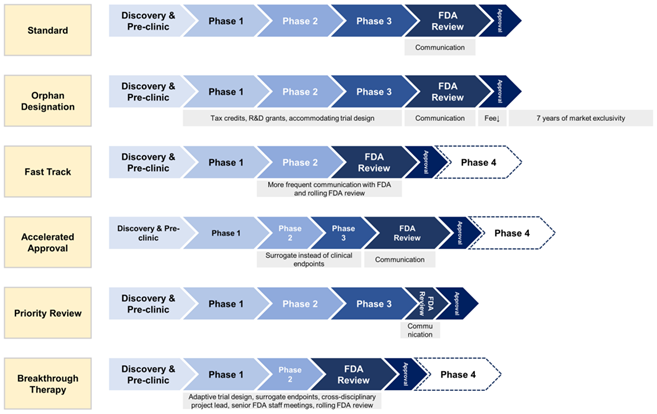
图1:FDA审查途径和名称
在过去20年中(2003年-2022年),FDA批准的药物中三分之二的新药至少获得一个特殊称号。在新药批准中,有55%药品获得优先审查、42%被指定为孤儿、32%获得快速通道、29%获得突破性治疗和15%获得加速批准。
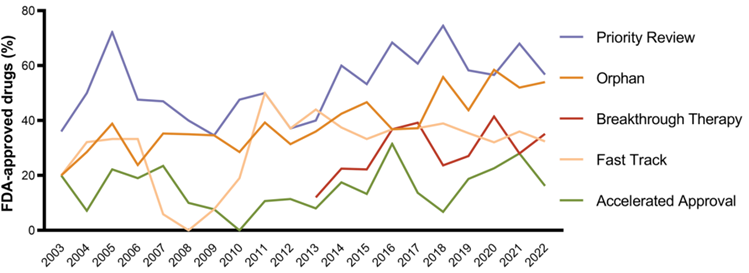
图2:2003年和2022年获得FDA特别批准的药物
其中,1992年设立的加速批准(Accelerated Approval,AA)是FDA对药物研发的特殊认定(为了应对 1980 年代的 HIV 流行,开发的加速批准途径),加速批准使FDA能够根据替代终点而不是临床终点来判断药物的疗效。
替代终点简单而言就是说异常的生物标志物恢复正常,目前常见的指标有药代动力学指标、体外检测指标、影像学指标、疾病生物标志物等。显而易见,替代终点较少了研究样本量,可以获得较早的研究结果。

图3:来源FDA官网(02/24/2023)
中国推行实施三个加速审批路径:包括2017年的优先审评、2020年的突破性疗法认定以及附条件批准。
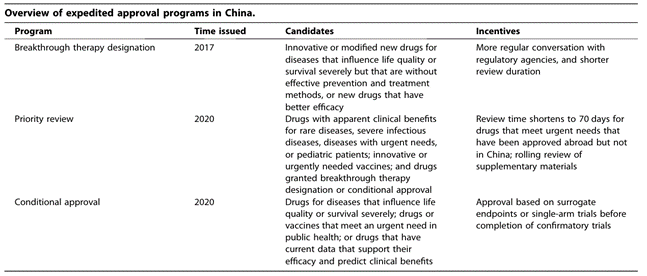
表1:中国快速审批项目

话说回来,那么如何知道药物是否为AA模式呢?一般药物的处方药物标签会显示,如下图(阿杜那单抗示例)。

图4:阿杜那单抗(Aducanumab)的说明书
FDA要求新药进行加速批准申请必须满足两个条件:(1)用于治疗严重疾病;(2)相对于已有治疗的药物,在可能预测临床益处的替代终点上具有显著的优势。
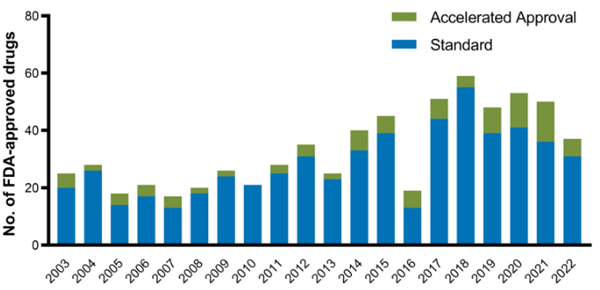
图5:从2003年到2022年获得FDA加速批准的药物
替代终点结果只能被视为“探索性”结果,换句话说,具有一定的“投机性”。较短和较小的试验对正确评估药物的风险和收益构成了挑战,FDA可能要求根据加速批准计划批准的药物进行上市后试验(4期试验)。然而,4期试验可能不启动或被推迟,只有少数4期试验报告了临床终点指标,也就是说,后续仍然可能出现迟迟未能完成确证性试验的情况。而那些完成的4期试验,则甚至会发现药物无效或有害而退出市场。
尽管加速批准起源于HIV治疗,但现在肿瘤学中大约三分之一的肿瘤药物批准使用该途径。
在上周(2024 年 4 月 7 日)发布于JAMA的文章中,哈佛大学研究者分析了2013年至2023年期间获得加速批准的129种癌症药物。
他们在第一项研究中发现,46个适应症中有29个(63%)转为常规批准,10个(22%)被撤回,7个(15%)仍未获得明确结果。总体而言,46 对药物适应症中有 26 个(57%)(其中,41%(19/46)的确证性试验没有改善总生存期或生活质量,另有15%(7/46)的结果尚未公布)在至少5年的随访后未能证明临床益处,这突显了治疗常用监管途径的不确定性。
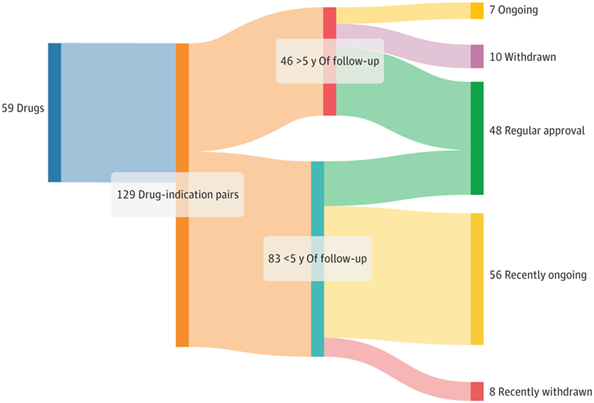
图6:2013年至2023年肿瘤药物加速获批监管结果(研究者进行了两项研究:1)着眼于随访超过五年的药物的总生存率和生活质量的改善;2)研究了已转换为常规批准的药物的验证性试验统计数据)
尽管加速批准可能有用,但一些抗癌药物最终并没有显示出延长患者寿命或改善生活质量的益处。对一款药上市而言,前期的优秀(的数据)可能成为完美(成功药品)的敌人。
毕竟,肿瘤治疗中OS是王道,但是比如在生存期长的情况下,ORR就得挑起大梁。
2023年3月,FDA发布了名为“Clinical Trial Considerations to Support Accelerated Approval of Oncology Therapeutics”新行业指南草案,概述了这一重要药物批准计划的潜在改革。

图7:FDA发布的行业指南草案
新指南草案第一个建议旨在通过更加重视随机对照试验(RCT)来取代单臂试验,从而进一步提高数据质量并提高临床试验效率。即:以随机对照试验支持加速审批。
试验申办者可以:(1)进行两项单独的RCT,其中一项试验基于早期替代终点(如客观缓解率(ORR)支持AA,另一项后期试验确认临床获益——例如,基于无进展生存期(PFS)或总生存期(OS);或者(2)选择“单试验”方法,使用单个试验来支持基于替代终点的初始AA,并且随着试验的成熟,还可以证明基于生存终点的临床益处,从而允许转化为完全批准。
第二个建议侧重于使用单臂试验来支持AA。尽管单臂试验有局限性,但该指南指出,“当对随机对照试验的可行性存在重大担忧时”此类试验是可以接受的。第三项建议对AA后的确认性试验提供了具体的指导,FDA指出“可以酌情要求在批准前或批准后的特定时间内进行旨在验证临床益处的研究”。
总之,指南旨在收紧AA的尺度,提高用于支持审批的临床依据标准。毕竟,包括通过AA途径上市的阿尔茨海默症药物阿杜那单抗至今仍争议不断。

图8:阿杜那单抗争议
尽管药物审批流程的标准(安全性和有效性)自1962年成立以来一直未变,但包括加速审批在内的五种特殊指定和审查途径为公司在针对疾病和治疗的临床试验中研究药物提供了更大的灵活性,也为FDA根据更广泛的疗效指标批准药物提供了更大的灵活性。
三十而立,“加速批准”至今已过而立之年。
FDA“放水”三十多年,“减速”机制仍在探索中前行。让加速审批不被“挟持”,成为治疗突破而不是底线突破,仍在路上……
参考文献:
1. https://www.accessdata.fda.gov/drugsatfda_docs/label/2023/761178s007lbl.pdf
2.https://www.fda.gov/patients/fast-track-breakthrough-therapy-accelerated-approval-priority-review/accelerated-approval
3.https://www.fda.gov/regulatory-information/search-fda-guidance-documents/clinical-trial-considerations-support-accelerated-approval-oncology-therapeutics
4. Michaeli DT, Michaeli T, Albers S, Boch T, Michaeli JC. Special FDA designations for drug development: orphan, fast track, accelerated approval, priority review, and breakthrough therapy. Eur J Health Econ. 2023 Nov 14. doi: 10.1007/s10198-023-01639-x. Epub ahead of print. PMID: 37962724.
5. Liu ITT, Kesselheim AS, Cliff ERS. Clinical Benefit and Regulatory Outcomes of Cancer Drugs Receiving Accelerated Approval. JAMA. 2024 Apr 7. doi: 10.1001/jama.2024.2396. Epub ahead of print. PMID: 38583175.
6. Alexander GC, Emerson S, Kesselheim AS. Evaluation of Aducanumab for Alzheimer Disease: Scientific Evidence and Regulatory Review Involving Efficacy, Safety, and Futility. JAMA. 2021 May 4;325(17):1717-1718. doi: 10.1001/jama.2021.3854. PMID: 33783469.
7. Wang S, Yang Q, Deng L, Lei Q, Yang Y, Ma P, Men Y, Yung BC, Lee RJ, Zhang M, Li N. An overview of cancer drugs approved through expedited approval programs and orphan medicine designation globally between 2011 and 2020. Drug Discov Today. 2022 May;27(5):1236-1250. doi: 10.1016/j.drudis.2021.12.021. Epub 2021 Dec 29. PMID: 34971818.
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论