
一、概述
申报资料是开展临床试验或药品上市申请的敲门砖,无论创新药还是仿制药,申报资料都是说服审评专家获得审批的重要筹码,因此递交一份高质量的申报资料在药品研发工作中至关重要。
随着CTD格式的推广,申报资料逐渐走向规范化、统一化、国际化。申报资料不仅仅是简单的申报文件格式要求,更是QbD理念的重要体现,为药物研发提供了研发思路,并对研究内容和研究水平做了系统性技术要求,因此,以撰写完美的申报资料为终点,反过来指导研发过程是提升研发质量,加快研发速度行之有效的方法。
二、申报资料构成及相对应的研发内容
依据ICH M4,申报资料包含5个模块,其中模块3主要是药学相关研究工作,下图是模块3的相关内容。
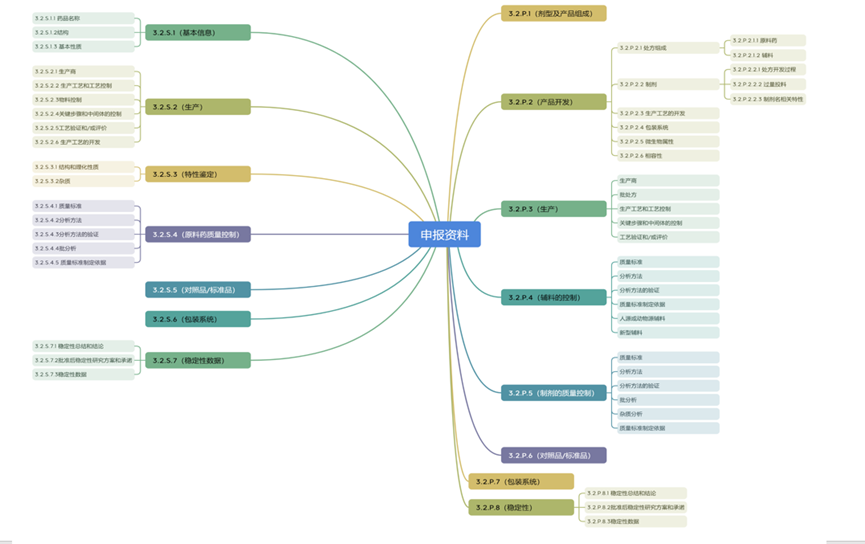
基于模块3构成,谈一谈IND阶段质量研究相关的具体工作。
表1 原料药申报资料及对应的研发内容
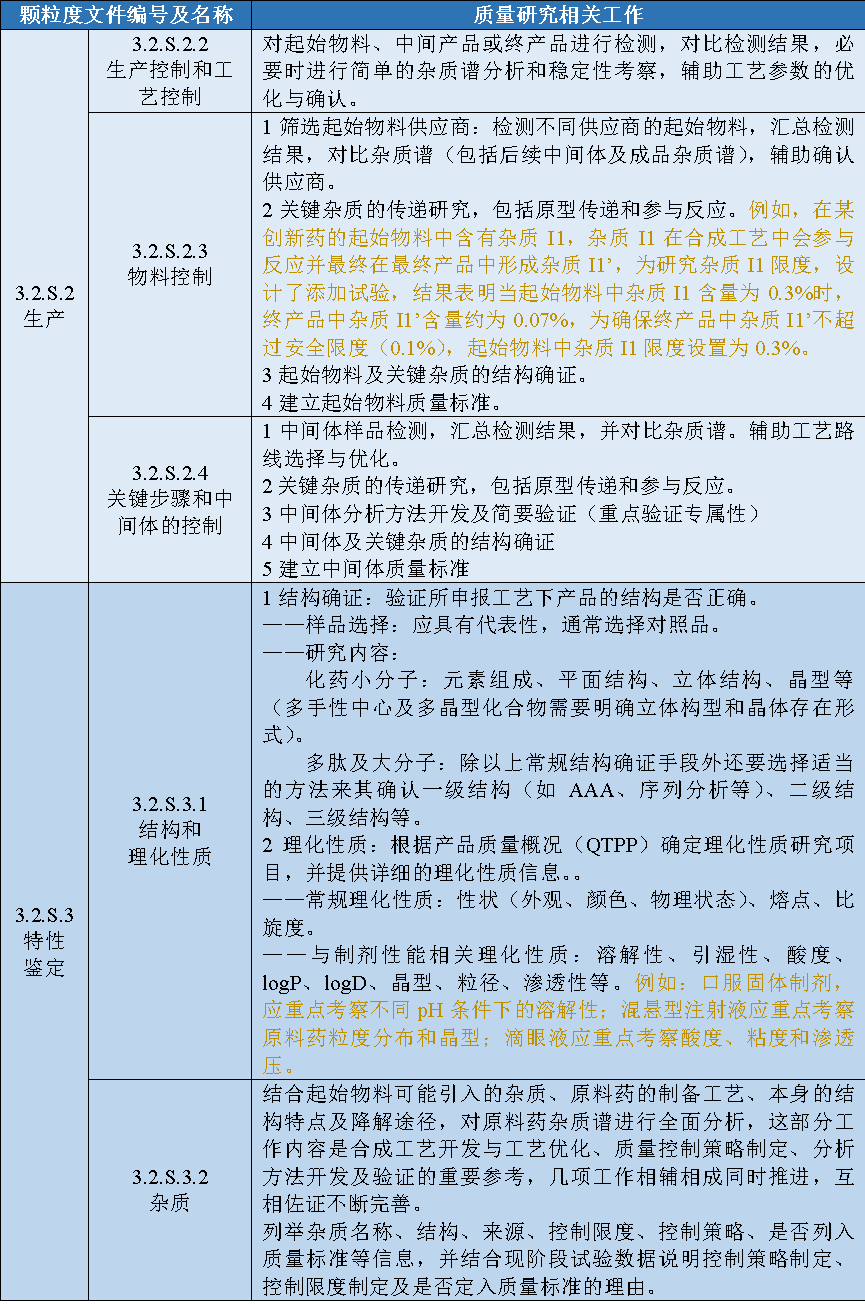
表2 制剂申报资料及对应的研发内容

三、小结
申报资料是科研工作的高度凝练与总结,科研工作是申报资料的事实依据,两者相辅相成。在药品研发的工作中,埋头做实验的同时,也要及时抬头站在申报资料的角度审视我们的研发思路是否符合逻辑,试验设计是否合理,研发内容是否全面,边做边梳理,力争通过我们精心设计的研发工作,借助于申报资料,向审评老师讲好自己的新药故事。
参考资料:
[1]《新药I期临床申请技术指南》
[2]《化学药品创新药I期临床试验申请药学共性问题相关技术要求》
[3] 鱼刚,CTD 格式申报资料撰写的探讨,中国药事,2015,29(5)。
[4]王亚敏,CTD 格式申报资料中制剂处方工艺部分解读,中国医药工业杂志,2012, 43(9)。
[5]康建磊,CTD格式申报资料中原料药特性鉴定部分的解读,新药申报与审评技术,2016,26(18)。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论