
本土创新药企业的研发实力,已逐步得到海外市场认可,国产创新药正在昂首挺胸走向自己的航海时代,其中抗体偶联药物(ADC)正成为国产创新药企业出海的巨艇。
公开资料显示,2023年有约12家中国公司研发的15款ADC实现海外授权,其中多项授权交易的总金额超10亿美元。在刚刚到来的2024年,宜联生物与罗氏达成全球独家许可协议合作开发下一代肿瘤治疗抗体偶联药物,这笔超10亿美元的重磅交易打响了新年ADC出海第一枪。
本文将分享2023-2024年以来备受关注的十余款国产ADC “license-out”案例以供参考。
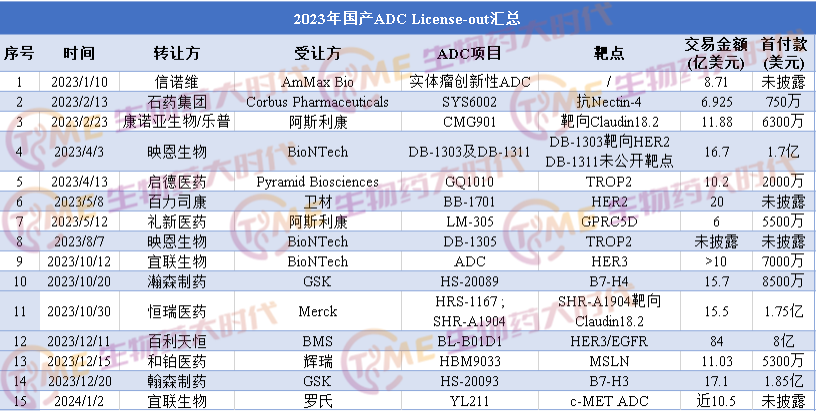
一、信诺维:AmMax Bio引进其用于实体瘤治疗的新一代ADC,交易达8.71亿美元

1月6日,信诺维宣布与AmMax Bio就一款用于实体瘤治疗的创新性ADC达成除大中华区外的全球研发和商业化的独家转让权协议。
该独家转让权协议包含双方协商好的授权条款(licensing terms),协议执行后,信诺维将获得最高达$8.71亿美元的支付款,包含首付款和开发,注册及销售里程碑。同时按照本协议,双方将协作完成合作项目的IND申请以及剂量递增临床研究的设计。

该ADC采用新一代的毒素-链接(linker-payload)和抗体, 并已经在多种临床前动物模型中展现出优越的抗肿瘤活性,预期可用于多种实体瘤的治疗。同时,临床前的疗效和毒理研究表明该ADC具有更宽的治疗窗口。目前已有数据表明,该ADC的临床疗效和安全性特征对比同类ADC项目将会有大幅提高。
二、石药集团:Corbus引进其抗Nectin-4 ADC,交易达6.925亿美元

2月13日,石药集团宣布其附属公司石药集团巨石生物已与Corbus Pharmaceuticals就重组人源化抗Nectin-4抗体偶联药物(ADC)SYS6002在美国、欧盟、英国、加拿大、澳大利亚、冰岛、列支敦士登、挪威及瑞士(下称:该地区)的开发及商业化订立独家授权协议。
根据该协议的条款,石药巨石生物同意授予Corbus Pharmaceuticals在该地区开发及商业化SYS6002的独家授权。石药巨石生物将收取750万美元的首付款,并有权收取最多1.3亿美元的潜在开发及监管里程碑付款,以及最多5.55亿美元的潜在销售里程碑付款。石药巨石生物还有权按SYS6002在该地区的年度销售淨额计算收取分层销售提成。石药巨石生物将保留该产品在全球其他市场的所有权利。

SYS6002是一款重组人源化抗Nectin-4 ADC。Nectin-4能促进肿瘤增生、血管生成、淋巴管生成及淋巴转移,在健康成人组织中的表达量非常低。然而,在多种类型癌症中,包括膀胱癌、三阴性乳腺癌、肺癌、结直肠癌、胰腺癌及卵巢癌,Nectin-4的表达被重新激活并有高表达量。此外,Nectin-4的正调控也是一些癌症类型中总体生存率较差的独立生物标记物。由于在癌症中的选择性表达,Nectin-4已成为治疗各种癌症的潜力靶点。
三、康诺亚生物/乐普生物:阿斯利康引进其Claudin18.2 ADC,交易达11.88亿美元

2023年2月23日,康诺亚生物和乐普生物共同宣布,与阿斯利康(AstraZeneca)就CMG901达成全球独家授权协议。阿斯利康将负责CMG901的全球研发、制造和商业化。由康诺亚和乐普生物合资设立的KYM Biosciences将获得6300万美元的预付款以及最多11.25亿美元的潜在额外研发、销售相关的里程碑付款。

CMG901是一款靶向Claudin18.2的全新ADC产品,正在针对Claudin18.2阳性表达的实体瘤开展1期临床研究。CMG901由KYM Biosciences Inc.(KYM)所有,KYM 是康诺亚(KYM 70%的所有权)和乐普生物(KYM 30%的所有权)成立的合资企业,旨在共同开发、商业化和制造 CMG901。
四、映恩生物:BioNtech引进其三款ADC药物,交易16.7亿美元
2023年4月3日,映恩生物DualityBio宣布与BioNTech就两款抗体偶联药物(ADC)管线DB-1303及DB-1311达成独家许可和合作协议。BioNTech将获得两款抗体偶联药物ADC在全球(不包括中国大陆、香港和澳门)的开发、生产和商业化的权利,而DualityBio映恩生物将保留这两款抗体偶联药物在中国大陆、香港以及澳门的开发、生产和商业化的权利。
根据协议,DualityBio映恩生物将获得总计1.7亿美元的首付款,并有望获得总金额超过15亿美元的开发、注册和商业化里程碑付款,以及未来潜在销售净额的单位数至双位数比例的提成作为特许权使用费。
8月7日,BioNTech宣布又引进映恩生物第3款ADC新药DB-1305,靶向Trop2。目前,DB-1305 正在进行实体肿瘤的1/2期临床试验(NCT05438329)。本次合作是基于两家公司于今年4月宣布的战略合作关系的进一步拓展。合作交易的财务条款均未披露。

五、启德医药:Pyramid Biosciences引进其TROP2 ADC,交易达10.2亿美元
2023年4月13日,Pyramid Biosciences宣布已与签订独家许可协议,在除大中华区(中国大陆、香港、澳门和台湾地区)外全球范围内,开发和商业化启德医药一款靶向TROP2的抗体偶联药物(ADC)GQ1010。
根据协议条款,Pyramid Biosciences将开发并商业化GQ1010,启德医药将获得2000万美元预付款和高达10亿美元的额外里程碑付款,并有资格获得净销售额的分级特许权使用费。

研究表明,TROP2在很多不同类型的人类肿瘤中都呈现高表达,且其在肿瘤发生、发展和侵袭中具有重要作用。靶向抑制TROP2的抗体能够在动物癌症模型中有效抑制多种肿瘤细胞生长,且与多种抗肿瘤疗法展现出了协同效果。GQ1010利用独特的位点特异性缀合技术,并结合了一种新型的连接物有效载荷,这可能会提高ADC的稳定性、安全性和效力。临床前数据表明, GQ1010具有更宽的治疗范围,有望提高GQ1010的疗效和安全性。
六、百力司康:卫材引进其ADC,交易超20亿美元

2023年5月8日,卫材引进百力司康的HER2 ADC产品BB-1701,百力司康获得总计高达20亿美元的开发与商业化里程碑付款, 以及销售分成。
BB-1701是一款以艾立布林为毒素的治疗癌症的人表皮生长因子受体-2(HER2)抗体偶联药物(ADC)。根据协议,百力司康和卫材将就BB-1701进行共同开发。如卫材行使BB-1701战略合作的选择权,百力司康会获得相应的行权付款,同时将获得总计高达20亿美元的开发与商业化里程碑付款, 以及销售分成,卫材会获得BB-1701的全球(除大中华区外)开发和商业化权益。

七、礼新医药:阿斯利康引进其靶向GPRC5D ADC,交易额约6亿美元
2023年5月12日,礼新医药宣布已与阿斯利康就临床前阶段的GPRC5D靶向ADC LM-305项目达成全球独家授权协议。
根据协议条款,阿斯利康将获得LM-305的研究、开发和商业化的独家全球许可。礼新医药将有资格获得包括首付款在内共计5,500万美元的近期付款,以及最高达5.45亿美元的潜在开发和商业里程碑付款,外加全球净销售额的分级特许权使用费。

LM-305是一种具有同类首创分子潜力的新型GPRC5D靶向抗体偶联药物,由抗GPRC5D单克隆抗体、蛋白酶可降解连接子和细胞毒素载荷单甲基奥瑞他汀E (MMAE) 组成。LM-305是礼新医药基于独家ADC平台自行研制开发的第二款产品,目前已在美国和中国获得IND新药临床试验批准。
八、宜联生物:BioNTech引进其HER3 ADC,交易超过10亿美元
10月12日,宜联生物宣布已与BioNTech达成战略合作和全球许可协议,双方将合作开发靶向人表皮生长因子受体3(HER3)的下一代抗体偶联药物候选产品。
根据协议条款,宜联生物将授予BioNTech其所拥有的一款ADC产品在全球范围内(不包括中国内地、香港和澳门)开发、制造和商业化的独家权利。BioNTech将向宜联生物支付7000万美元首付款,以及额外开发、监管和商业化里程碑付款,潜在总金额超过10亿美元。该协议的完成将受制于常规交易达成条件,包括根据哈特-斯科特-罗丁诺(“HSR”)反垄断改进法案的批准。
九、瀚森制药:GSK引进其新型B7-H4靶向ADC,交易总计15.7亿美元
10月20日,翰森制药宣布与GSK达成合作,授予对方自研 B7-H4 ADC新药HS-20089的全球独占许可(不含中国大陆、香港、澳门及台湾地区)。根据许可协议,翰森将收取8500万美元首付款,并有资格收取最多14.85亿美元的里程碑款项。商业化后,GSK还将就许可地区内的全球净销售额支付分级特许权使用费。
HS-20089是一种新型B7-H4靶向ADC,其有效载荷为拓扑异构酶抑制剂(TOPOi)。B7-H4是B7超家族中的一种跨膜糖蛋白,在正常组织中表达有限,但在多种癌症中高表达。该产品正在中国进行用于治疗晚期实体瘤的1期临床研究。
十、恒瑞医药:Merck引进其靶向Claudin 18.2 ADC,交易约15.5亿美元
2023年10月30日,恒瑞医药发布关于与Merck Healthcare签署HRS-1167和SHR-A1904项目授权许可协议的公告。将具有自主知识产权的1类新药HRS-1167片和注射用SHR-A1904项目有偿许可给Merck Healthcare。
Merck Healthcare将向恒瑞支付1.6亿欧元的首付款,不超过12.55亿欧元里程碑付款,总金额达到14.15亿欧元(约15.5亿美元)。

HRS-1167为恒瑞自主研发且具有知识产权的高选择性、高活性、可口服的PARP1小分子抑制剂,属于第二代PARP抑制剂。SHR-A1904为恒瑞自主研发且具有知识产权的靶向Claudin 18.2的抗体药物偶联物(ADC),其有效载荷是拓扑异构酶抑制剂(TOPOi)。目前全球范围内暂无高选择性PARP1抑制剂产品和Claudin 18.2 ADC产品获批上市,同类产品在国内外尚处于临床试验阶段,暂无相关销售数据。
十一、百利天恒:百时美施贵宝(BMS)引进其双抗ADC,交易高达84亿美元
2023年12月11日,BMS引进百利天恒子公司SystImmune EGFR x HER 3双抗ADC药物BL-B01D1。BL-B01D1是百利天恒根据HER3/EGFR双抗SI-B001开发的双抗ADC,目前处于III期研究阶段。
根据协议,SystImmune保留中国大陆的独家权益,百时美施贵宝将获得BL-B01D1除中国大陆以外地区的独家开发和商业化权益。为此,BMS需向百利天恒支付8亿美元的首付款、最高达5亿美元的近期或有付款,以及最高至71亿美元的里程碑付款。总的潜在交易费用高达84亿美元。

十二、和铂医药:辉瑞引进其MSLN ADC,交易超10亿美元
12月15日,和铂医药宣布与辉瑞达成授权合作,和铂医药子公司诺纳生物将MSLN ADC新药HBM9033的全球权益授权给辉瑞子公司Seagen,后者支付5300万美元预付款和近期付款,10.5亿美元里程碑金额,以及高个位数到高十位数不等的销售分成。
协议标志着和铂医药的Harbour Mice®平台及Seagen的ADC生态圈业务发展的重要里程碑,验证了本公司技术平台的潜力及创新能力。和铂医药亦将利用该机会,透过其创新合作模式进一步加强其全球合作网络,并最大化公司技术平台的科学和商业价值。

十三、翰森制药:GSK引进其B7-H3 ADC,交易达17.1亿美元
12月20日,翰森制药与葛兰素史克(GSK)共同宣布双方就翰森制药自主研发的ADC新药HS-20093达成独家许可协议。
根据协议条款,翰森制药将授予葛兰素史克开发、生产及商业化HS-20093全球独占许可权利(不含中国大陆、香港、澳门及台湾地区)。翰森制药将获得1.85亿美元首付款,并有资格获得最多15.25亿美元的成功里程碑付款。该产品商业化后,葛兰素史克还将就中国大陆、香港、澳门及台湾地区以外的全球净销售额支付分级特许权使用费。

该协议为葛兰素史克提供了第二个临床阶段的ADC,补充了葛兰素史克在开发药物方面的现有能力和优势,以满足各种实体瘤中未满足的医疗需求。HS-20093目前正在中国进行I期和II期试验。 HS-20093治疗晚期实体瘤的ARTEMIS-001 I 期试验 (NCT05276609) 的数据已在 2023 年美国临床肿瘤学会 (ASCO) 年会上公布,结果显示,HS-20093在小细胞肺癌、非小细胞肺癌和肉瘤中观察到初步的临床有效性,具有多个得到确认的疾病缓解和可管理的安全性。
十四、宜联生物:罗氏引进其c-MET ADC,交易近10.5亿美元
2024年1月2日,宜联生物宣布已与罗氏(Roche)达成全球合作和许可协议,双方将合作开发靶向间质表皮转化因子(c-MET)的下一代抗体偶联药物候选产品YL211(c-MET ADC),用于治疗实体瘤。

根据协议条款,罗氏将获得宜联生物YL211项目在全球范围内的开发、制造和商业化的独家权益。宜联生物将与罗氏中国创新中心(CICoR)共同合作推动YL211项目进入临床1期试验阶段,并交由罗氏负责后续全球范围内进一步开发和商业化工作。罗氏将向宜联生物支付首付款及近期里程碑付款5000万美元,另外还有近10亿美元的开发、注册和商业化潜在里程碑付款,以及未来基于全球年度销售净额的梯度特许权使用费。
参考:
各公司官网披露;
药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论