
据药融云《全球在研新药与靶点月报》数据统计,在10月全球多款备受关注的在研创新药研发迎来了重要进展,诺华、默沙东、礼来、强生、恒瑞医药、百济神州等企业的在研创新药也迎来了积极临床结果。
在精神疾病领域,强生公司的Spravato(esketamine)CIII鼻喷雾剂在治疗难治性抑郁症(TRD)患者的3b期试验中取得了积极结果,并登上《新英格兰医学杂志》。
分析显示,与活性对照组相比,Spravato组在第8周时有更多的(1.54倍)患者出现缓解(91/336,27.1%vs.60/340,17.6%;P=0.003),并且有较多患者(1.55倍)在第8周缓解后至第32周无复发(73/336,21.7%vs.48/340,14.1%)。在32周的随访中,缓解患者的百分比、应答患者的百分比和MADRS抑郁评定量表(一种用于评估抑郁症状严重程度的工具)较基线的变化均支持Spravato鼻喷雾剂。
Spravato全球研发现状
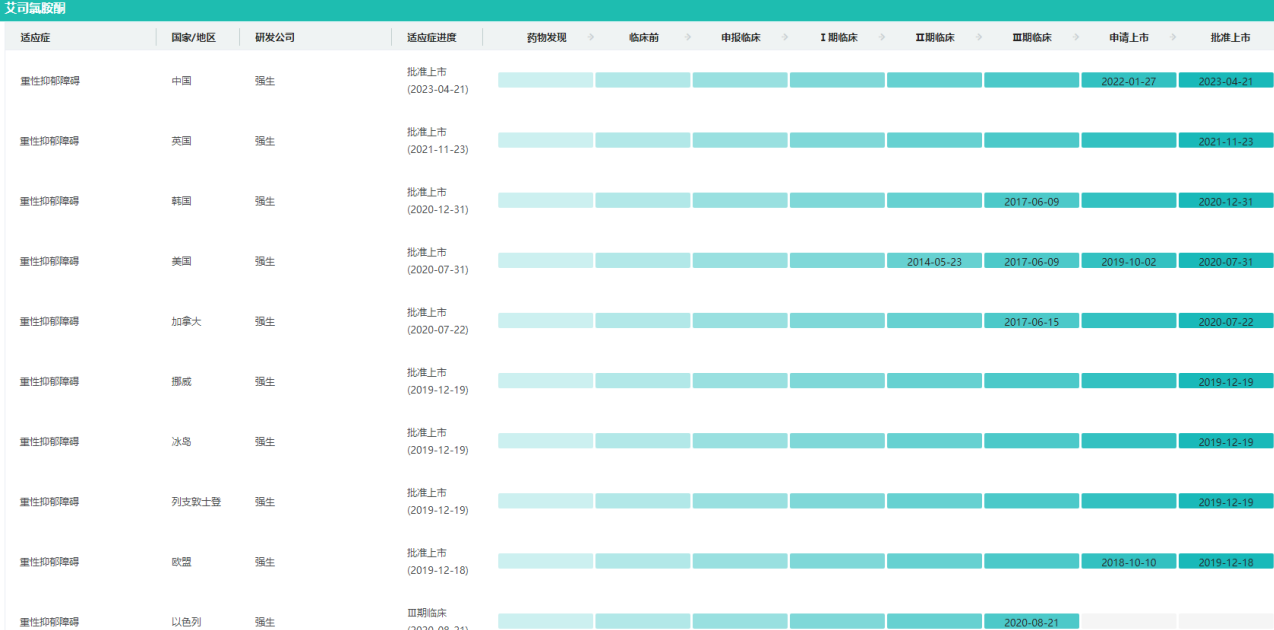
图片来源:药融云全球药物研发数据库
抑郁症是一种常见的精神疾病,全球约2.8亿患者。近2/3抑郁症患者无法从现有疗法中获得充分缓解。当重度抑郁症患者对2种及以上的治疗方法没有反应时,就可能进展为难治性抑郁症,这些患者对于新的治疗方法有巨大的需求。
Spravato鼻喷剂是一种非选择性、非竞争性NMDA受体拮抗剂,可能帮助修复抑郁症患者大脑细胞的神经连接。该疗法获得美国FDA批准治疗TRD和MDSI成人患者。2023年4月,SPRAVATO(盐酸艾司氯胺酮鼻喷雾剂,商品名:速开朗,英文通用名:Esketamine Hydrochloride Nasal Spray)获得在中国批准上市,用于与口服抗抑郁药联合,缓解伴有急性自杀意念或行为的成人抑郁症患者的抑郁症状。
在肾病领域,诺华(Novartis)公布其预定的APPLAUSE-IgAN临床3期试验的中期分析(9个月)积极顶线结果。APPLAUSE-IgAN是一项多中心、随机双盲、安慰剂对照、平行组的3期研究,在470例成人原发性IgAN患者中评估每日两次口服iptacopan(200mg)的疗效和安全性。
分析显示,APPLAUSE-IgAN试验达到了其预定的中期分析主要终点,证明了iptacopan与安慰剂相比在减少蛋白尿方面的优效性。在这项研究中,iptacopan(200mg,每日两次)的安全性特征与之前报道的数据一致。该研究继续以双盲的方式,通过测量24个月内估计的肾小球滤过率(eGFR)斜率来评估iptacopan减缓IgAN进展的能力。
iptacopan全球临床试验查询
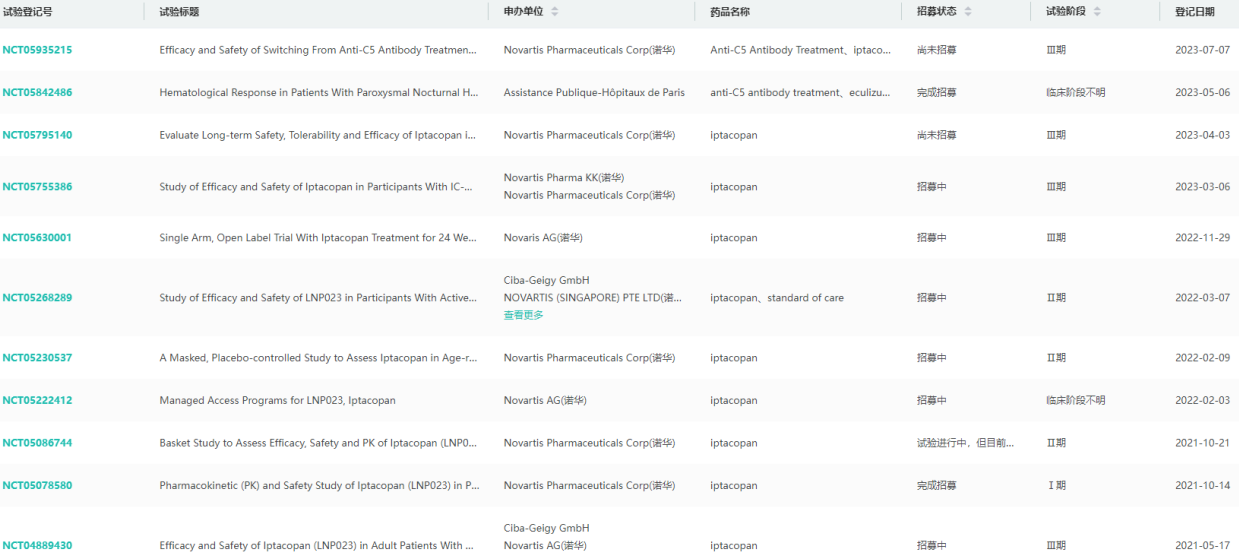
图片来源:药融云全球临床试验数据库
IgA肾病是导致慢性肾脏病和肾功能衰竭的主要病因,是一种与进行性肾损伤相关的慢性、进行性自身免疫性疾病。IgA肾病患者的主要特点是存在循环和肾小球免疫复合物。IgA肾病进展会伴发肾小球硬化、肾间质纤维化、肾功能不全、蛋白尿和高血压。其中50%的IgA肾病患者在30年内会发展为终末期肾病,严重影响患者的生活质量。
在肿瘤领域,恒瑞医药的创新药达尔西利联合吡咯替尼治疗HER2阳性晚期乳腺癌的2期探索性研究正式发表于《自然》子刊NatureCommunications。
分析显示,疗效分析集中的受试者接受了中位值25.9个月的随访,客观缓解率(ORR)达70%,临床获益率(CBR)为75.0%,中位缓解持续时间为15.8个月,受试者的中位无进展生存期(mPFS)为11.0个月。在HER2阳性、任意HR状态的晚期乳腺癌前线治疗中,达尔西利联合吡咯替尼显示了较好的疗效和可控的安全性。
药融云数据库显示,达尔西利是高度选择性小分子CDK4/6抑制剂,已经在中国获批治疗HR阳性、HER2阴性晚期乳腺癌。吡咯替尼是靶向HER1、HER2、HER4的口服不可逆pan-ErbB受体酪氨酸激酶抑制剂(TKI),已在中国获批治疗HER2阳性晚期乳腺癌;2022年吡咯替尼在全国医院终端市场的销售规模超13亿元。
吡咯替尼医院端市场的年度销售趋势
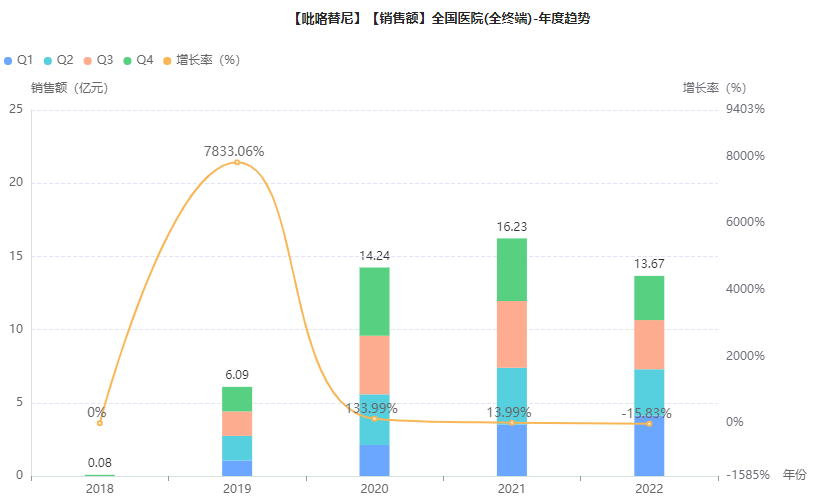
图片来源:药融云全国医院销售(全终端)数据库
在肺癌领域,默沙东(MSD)公司的重磅PD-1抑制剂Keytruda在治疗可切除的II期,IIIA期或IIIB期非小细胞肺癌(NSCLC)患者的关键性3期临床试验KEYNOTE-671中达到总生存期(OS)的主要终点。
分析显示,Keytruda与化疗联用作为术前新辅助治疗,并在手术后单药作为辅助治疗,与安慰剂与化疗联用作为新辅助治疗,加术后安慰剂辅助治疗相比,接受基于Keytruda治疗方案的患者,中位无事件生存期(EFS)尚未达到(95%CI,34.1-NR),接受单独化疗的患者的EFS为17个月(95%CI,14.3-22)。这是在这类患者中首个显示统计显著总生存期获益的3期临床试验。
同时,百济神州的多款在研产品的最新临床结果入选了2023年欧洲肿瘤内科学会(ESMO)大会。其中,PD-1抑制剂替雷利珠单抗分别治疗晚期胃或胃食管结合部(G/GEJ)腺癌和非小细胞肺癌(NSCLC)的两项3期研究入选年会最新突破摘要(LateBreakingAbstract,LBA)。
百济神州申报药品TOP10
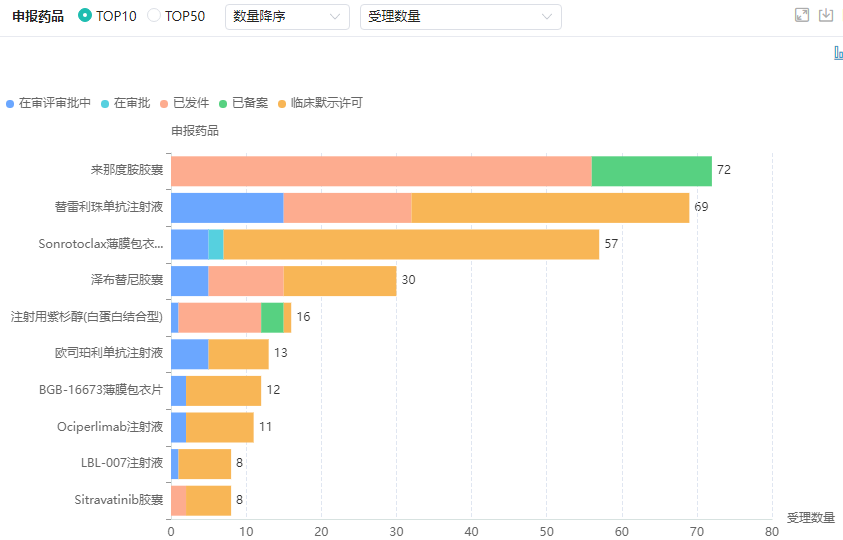
图片来源:药融云中国药品审评数据库
RATIONALE315试验是一项随机、双盲、安慰剂对照的3期临床研究,目的是评估可切除II-IIIA期NSCLC患者对新辅助替雷利珠单抗联合含铂双药化疗的病理学缓解。新辅助治疗期的疗效和安全性数据与化疗相比,替雷利珠单抗联合化疗作为新辅助治疗显著提高了MPR率(56.2%vs15.0%)和pCR率(40.7%vs5.7%)。
替雷利珠单抗联合化疗不影响手术的可行性。RATIONALE-305试验是一项随机、双盲、安慰剂对照、全球3期临床试验,目的是在晚期不可切除或转移性胃或胃食管结合部腺癌一线治疗中,探索替雷利珠单抗联合化疗(铂类和氟尿嘧啶类药物)对比安慰剂联合化疗的有效性和安全性。
这些研究结果对于相关疾病领域来说具有重要意义,也为未来的药物研发提供了新的方向和思路。
<END>
想要实时掌握全球在研创新药积极/失败临床结果最新动态,了解国产创新药国际化动态,请订阅药融云《全球在研新药与靶点月报》。


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论