2022年底,国家知识产权局和国家医疗保障局联合发布了《关于加强医药集中采购领域知识产权保护的意见》,以协同强化医药领域知识产权保护,形成多层次、高效率的知识产权纠纷防范和化解联动机制。从发布内容看对于以后集采品种会更加关注知识产权保护,尽量避免将存在知识产权纠纷的产品纳入集采。这必将促使仿制药企业更加关注知识产权,尽量避免出现专利侵权,因为一旦陷入知识产权纠纷,将会失去集采资格。
今年2月10日,浙江省药械采购平台发布了一则暂停一款降糖药在线交易的通知,暂停了江苏中天药业有限公司和国药集团国瑞药业有限公司生产的苯甲酸阿格列汀片的在线交易。而被下架的原因,很可能是其仿制产品和原研厂家存在专利纠纷有关。更早前的去年8月份,在国家知识产权局裁定东阳光药业有限公司侵犯了勃林格殷格翰降糖药利格列汀片的专利权之后,上海阳光医药采购网、陕西公共资源交易中心等全国多地即取消了东阳光对该产品的挂网资格。
阿格列汀和利格列汀同为二肽基肽酶-4(DPP-4)抑制剂,加上其它已获批进口的维格列汀、西格列汀及沙格列汀,共有5个DPP-4抑制剂原研在国内上市。最新发布的《广东省DPP-4抑制剂评价与遴选专家共识》,对上述5个DPP-4抑制剂从药学特性、有效性、安全性、经济性、其他属性共5个维度进行了量化评分,最终总分均在70分以上。根据《中国医疗机构药品评价与遴选快速指南》“用于新品种引进时,70分以上为强推荐”。因明确的临床疗效和良好的市场表现,这5个DPP-4抑制剂成为仿制药研发中的热门品种。
从2019年至2022年,国内药企相继完成了对这5款进口DPP-4抑制剂首仿药的争夺,随后有多家仿制药密集获批。在国内获得生产批件是一回事,能否顺利进入市场销售又是另一回事。特别是在中国上市药品专利链接制度施行之前批准的仿制药,国家局并没有把原研专利作为批准生产批件时考虑的因素。本文按照这5款DPP-4抑制剂原研在中国获批时间的先后顺序逐个分析其在国内的专利情况,以探究仿制药企业在布局该类产品时的侵权风险。
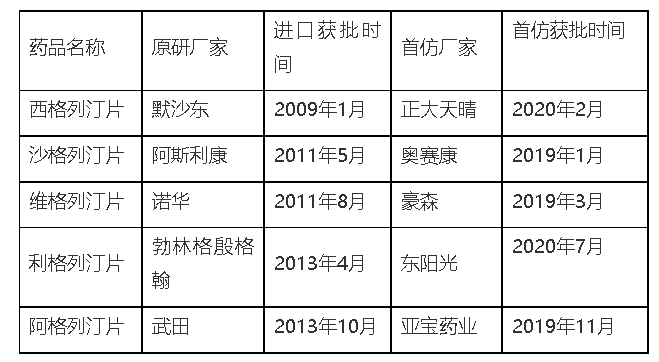
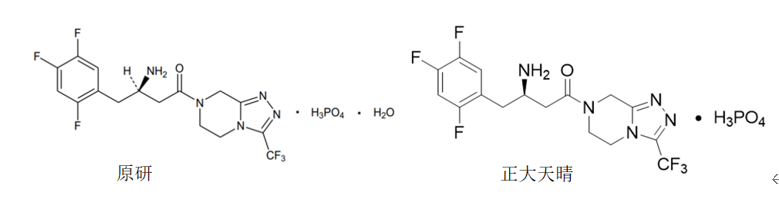
首先是西格列汀片。西格列汀(Sitagliptin)由默沙东研制,是全球第一个上市的口服DPP-4抑制剂,最早于2006年10月获美国FDA批准上市。2009年1月,磷酸西格列汀片获批落地中国,2017年进入国家医保目录。磷酸西格列汀在国内的化合物专利CN1290848C已于2022年7月4日到期,但其晶型专利CN100430397C,即保护磷酸结晶单水合物的专利有效期至2024年6月18日。因此要想提前上市就要绕开原研晶型专利,从国内已获批的西格列汀仿制药来看,虽然拿到了生产批件但大多并没有销售,只有正大天晴有上市销售。从正大天晴仿制药说明书信息可知,其开发的是不同于原研的晶型。
其次是沙格列汀片。沙格列汀(Saxaglipti)原研厂家为阿斯利康,最早由百时美施贵宝制药公司研发,于2009年获FDA批准上市,后被阿斯利康收购,2011年5月获批进入中国市场,自2017年起被纳入医保目录。沙格列汀化合物专利CN1213028C已于2021年到期。目前尚有一件制剂组合物专利CN 102895208 B还在保护期内,有效期至2025年。如要提前上市销售,需注意规避该制剂专利。因原研核心专利到期,多家仿制药获批上市,市场竞争充分,沙格列汀片已入选第五批国家集采品种目录,成为第二个进入集采的DPP-4抑制剂。首先是西格列汀片。西格列汀(Sitagliptin)由默沙东研制,是全球第一个上市的口服DPP-4抑制剂,最早于2006年10月获美国FDA批准上市。2009年1月,磷酸西格列汀片获批落地中国,2017年进入国家医保目录。磷酸西格列汀在国内的化合物专利CN1290848C已于2022年7月4日到期,但其晶型专利CN100430397C,即保护磷酸结晶单水合物的专利有效期至2024年6月18日。因此要想提前上市就要绕开原研晶型专利,从国内已获批的西格列汀仿制药来看,虽然拿到了生产批件但大多并没有销售,只有正大天晴有上市销售。从正大天晴仿制药说明书信息可知,其开发的是不同于原研的晶型。
再次是维格列汀片。维格列汀(Vildagliptin)是全球第二个上市的DPP-4抑制剂,由诺华公司研发,2007年获欧盟药品管理局上市,2011年8月获国家药监局批准进入国内市场,商品名:佳维乐®。2019年12月,维格列汀在中国的化合物专利到期。目前国内已有江苏豪森、齐鲁、北京泰德、南京圣和等多家制药企业的维格列汀仿制药获批上市。基于DPP-4抑制剂在口服降糖药领域的独特优势,加之原研药专利到期,市场竞争充分,维格列汀片被纳入第三批国家集采,成为首个进入集采的DPP-4抑制剂。
接下来是利格列汀片。利格列汀(Linagliptin)由勃林格殷格翰研发,于2011年6月在美国上市,2013年4月获批在中国上市。2020年7月,东阳光拿下利格列汀片的首仿,随后扬子江、石药欧意、科伦药业、华海药业等先后获批。对于利格列汀勃林格殷格翰在中国主要布局了5件专利,在化合物、用途、制剂组合物、联合用药、制备方法等方面进行了多维度的覆盖。虽然一件通式化合物专利CN101293888B已过期,但原研公司通过对通式化合物的进一步限定,缩小了保护范围,进一步申请了化合物专利CN100522962C,其保护期至2023年8月。另外其尚有多件制剂组合物专利,最晚保护期至2027年4月。

最后是阿格列汀片。阿格列汀(Alogliptin)由日本武田制药研发,2010年4 月在日本批准用于治疗2型糖尿病,并于2013年10月在中国获批进口药品上市,商品名“尼欣那”。针对苯甲酸阿格列汀片,武田制药在中国上市药品专利公示平台公示了7件药品专利,主要覆盖化合物、用途及制剂组合物方面。其中四件专利ZL201110006009.X、ZL201110006939.5、ZL201110005788.1、ZL201110004223.1“二肽基肽酶抑制剂”,专利有效期至2024年12月15日;ZL201210332271.8、ZL201210399309.3“用于治疗糖尿病的二肽基肽酶抑制剂”,专利有效期截至2026年9月13日。随着专利权期限的临近,2017年至今,武田制药遭遇多次专利挑战,发起专利无效宣告的请求人包括国瑞药业、四川科伦、亚宝药业、华威医药、江苏礼华生物等。但从公示平台的检索结果来看,这7件专利仍处于有效状态。可见其专利权较为稳定,在做仿制药研发时需注意规避。
小结:以上对获批进口的5个DPP-4抑制剂的国内原研专利情况进行了笼统的介绍。从上述分析可知,维格列汀、沙格列汀原研核心专利已过期,多家仿制药已获批并上市销售,且已经纳入国家集采,专利侵权风险较低。对于西格列汀、利格列汀、阿格列汀原研核心专利尚未过保护期,虽然有多家企业获得仿制药生产批件,但受制于原研专利限制,尚未上市销售。借此也提醒仿制药企业在布局仿制药研发时,需要更加关注和分析原研专利,在制定研发计划时需要考虑专利规避策略。
参考文献:
1、《关于加强医药集中采购领域知识产权保护的意见》
2、国瑞药业阿格列汀片被暂停在线交易,仿创专利纠纷再起波澜
3、东阳光利格列汀被判侵权多地撤网,原研药还面临哪些“危局”?
4、《广东省DPP-4抑制剂评价与遴选专家共识》
6、国家知识产权局网站
7、中国上市药品专利信息登记平台
8、FDA网站
9、国家药品监督管理局药品审评中心化学药品目录集
<END>


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论