
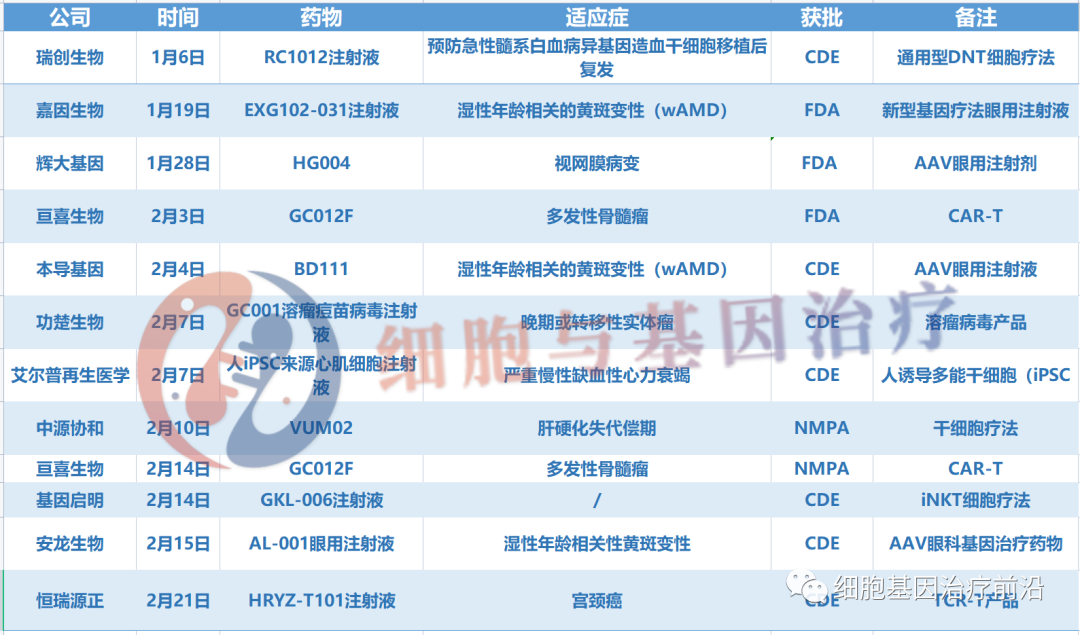
据药融云数据库统计,今年2月以来,国内细胞基因领域有14起IND获批事件,涉及13家企业,包括瑞创生物、辉大基因、本导基因、中源协和以及亘喜生物等,其中亘喜生物在本月成功完成中美双报。
2月国内细胞基因IND获批动态汇总
一、瑞创生物
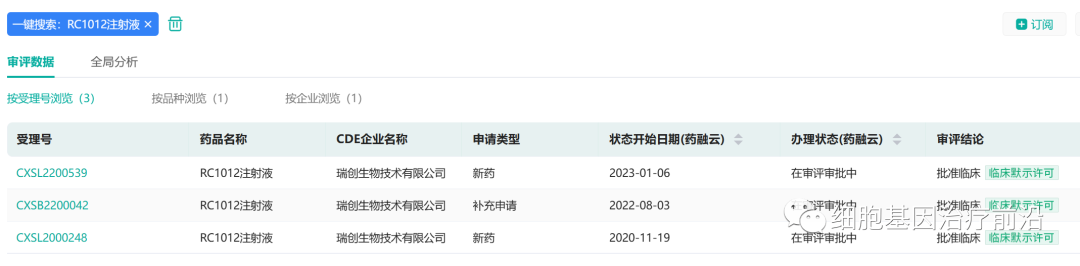
2023年1月6日,瑞创生物递交的“RC1012注射液预防急性髓系白血病异基因造血干细胞移植后复发” 适应症IND申请得到国家药品监督管理局(NMPA)药品审评中心(CDE)正式批准。
2022年8月,RC1012注射液冻存制剂获批IND临床试验,标志着RC012注射液有希望成为全球首款非基因编辑现货通用型免疫细胞新药,目前正在开展注册I期临床试验,计划在2023年进入关键性II期临床试验。
来源:药融云数据库
此次新适应症的批准,意味着RC1012注射液作为全球首款未经基因编辑的现货通用型DNT免疫细胞治疗产品的临床适应症得到进一步扩大。
二、嘉因生物
1月19日,嘉因生物宣布,FDA已批准其新型基因疗法EXG102-031注射液的新药临床试验申请(IND),用于治疗湿性年龄相关的黄斑变性(wAMD)。
EXG102-031是公司第二款新药IND获批,也是首款在美国获批IND的药物。2022年6月,其自主研发的AAV基因疗法EXG001-307注射液获批临床,拟定用于治疗1型脊髓性肌萎缩症(SMA 1)。
三、辉大基因
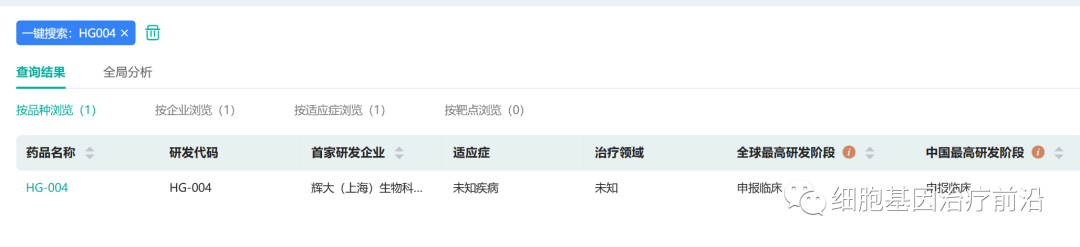
1月28日,辉大基因宣布,公司的自主研发眼科基因治疗候选药物HG004获得FDA授予的IND许可,并将在多国开展用于治疗RPE65基因突变引起的相关性视网膜病变的国际多中心临床试验。
来源:药融云数据库
此次HG004的获批标志着辉大基因首个IND许可的诞生,也意味着其第一个视网膜疾病管线正式进入临床开发阶段。
四、亘喜生物
2月3日,亘喜生物自体CAR-T候选产品GC012F的IND申请获得FDA批准,2月13日,获得中国国家药品监督管理局(NMPA)药品审评中心(CDE)批准,针对复发/难治性多发性骨髓瘤(R/R MM)。
 来源:药融云数据库
来源:药融云数据库
亘喜生物计划在美国开展1b/2期临床试验。2021年11月,GC012F已获FDA授予孤儿药资格,用于治疗多发性骨髓瘤。
五、本导基因
2月4日,CDE同意受理本导基因提交的BD111眼用注射液临床试验申请,用于治疗单纯疱疹病毒型角膜炎(HSK)的基因编辑眼用注射液。

来源:药融云数据库
BD111是继Editas与Intellia的体内基因编辑治疗管线之后,全球第3个进入IND和临床阶段的体内基因编辑治疗候选药物,也是全球首个CRISPR抗病毒基因编辑治疗药物。
六、功楚生物
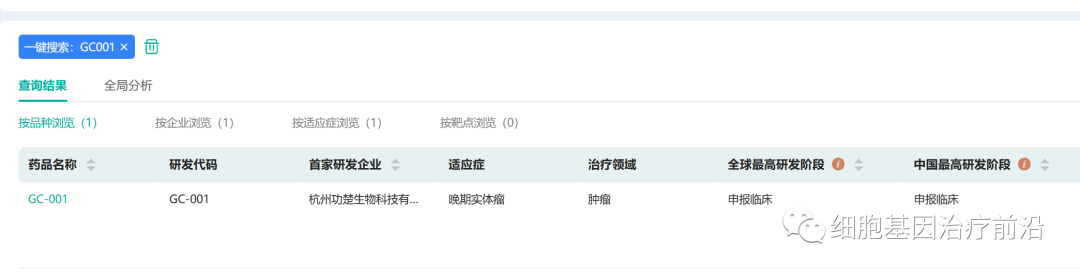
2月7日,功楚生物的“GC001溶瘤痘苗病毒注射液”获得临床默示许可。适应症为:晚期或转移性实体瘤。GC001是基于纹蛋白互作蛋白1(STRIP1)靶点的创新溶瘤病毒产品。
来源:药融云数据库
溶瘤病毒(OVs)作为癌症疗法具有良好的前景。许多其他有前途的OVs正在临床开发中,该领域正在进行的研究包括确定新的OVs递送方法,例如静脉内给药。
七、艾尔普再生医学
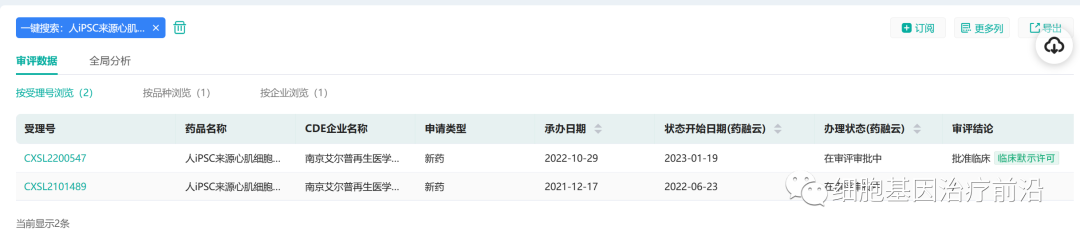
2月7日,艾尔普再生医学自主研发的心力衰竭细胞治疗产品“人iPSC来源心肌细胞注射液”新药临床试验(IND)申请获得临床试验默示许可。
来源:药融云数据库
“人iPSC来源心肌细胞注射液”是国际领先的人诱导多能干细胞(iPSC)来源的细胞治疗产品,也是国内首个获批临床的人iPSC来源心肌细胞治疗产品,拟用于治疗严重慢性缺血性心力衰竭。
八、中源协和
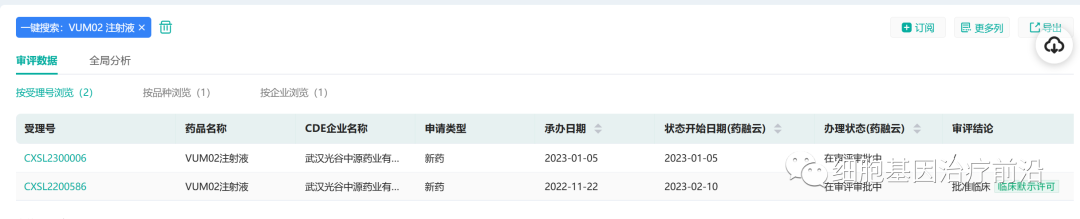
2月10,中源协和(600645)全资子公司武汉光谷中源药业有限公司收到国家药品监督管理局核准签发的关于VUM02注射液的《药物临床试验批准通知书》。
来源:药融云数据库
VUM02注射液临床拟用于治疗失代偿期肝硬化患者。截至目前,全球尚未有用于治疗失代偿期肝硬化的同类细胞药物上市,研发进展最快的同类药物处于临床试验阶段。
九、基因启明
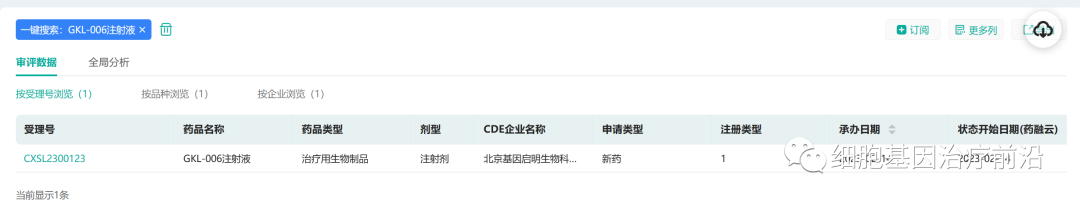
2月14日,据药融云数据库显示,基因启明细胞治疗产品“GKL-006注射液”IND申请获得受理。
来源:药融云数据库
基因启明目前已申请4项专利,三年内,预计将有15个以上专利和产品申请成功,形成产品管线。
十、安龙生物
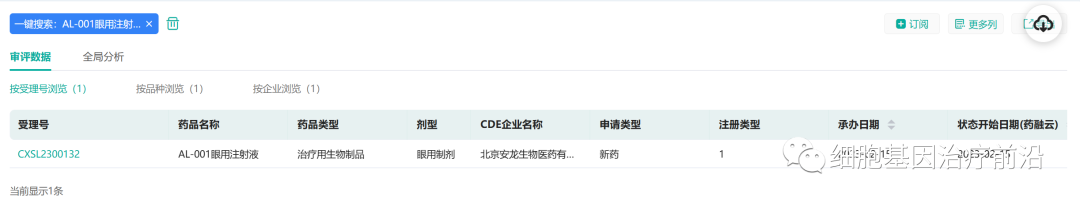
2月15日,安龙生物自主研发的AAV眼科基因治疗药物“AL-001眼用注射液”IND申请获得受理,适应症为:湿性年龄相关性黄斑变性。
来源:药融云数据库
安龙生物具有使用自主知识产权的AAV载体的wAMD治疗产品,其产品采用安龙自建的Sf9悬浮细胞AAV生产工艺,该生产工艺规模易放大、成本低,让wAMD患者用得起、用得安心。
十一、恒瑞源
2月21日,恒瑞源正自主研发的“HRYZ-T101注射液”新药IND申请获受理,这是公司第一个TCR-T产品,用于治疗宫颈癌。
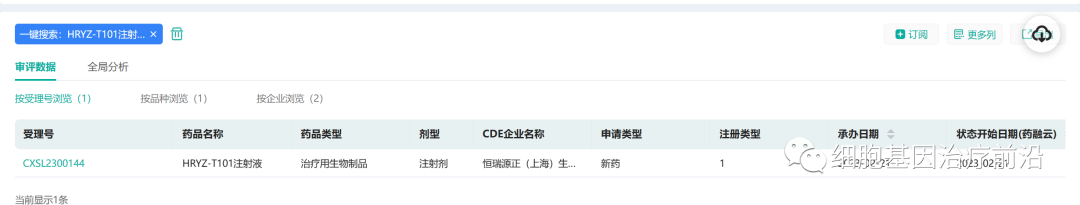
来源:药融云数据库
恒瑞源正在研产品管线有MASCT产品、TCR-T免疫细胞产品、TCR双抗产品。公司拥有自主知识产权的“多抗原自体免疫细胞注射液(MASCT-I)”已经获得国家药品监督管理局的临床试验批件,正在开展注册Ⅱ期临床试验研究。
参考资料:
[1] CDE
[2] 各公司官网
[3] 药融云数据库
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论