
2022年9月13日,纳斯达克上市公司Alvotech(NASDAQ: ALVO)收到了美国FDA的完整回复函(CRL),针对的产品是AbbVie修美乐(Humira)(阿达木单抗,adalimumab)的潜在可互换生物类似药(biosimilar)——AVT02。

CRL中讨论了位于冰岛雷克雅未克生产设施的几个缺陷项。

FDA公布了2022年3月份对该生产设施检查的结果,共有13个观察项,包括与进场物料控制、程序、质量控制、生产偏差管理、细菌和霉菌等相关的一些问题。
Alvotech首席执行官MarkLevick在此前一份声明中表示:“公司正在与FDA合作,力争在2022年12月PDUFA日期之前解决这些问题。”不过,目前FDA给予了延期,新的PDUFA日期为2023年4月13日。

Alvotech步入美国市场实可谓“步履维艰”,因为这场“战斗”早在一年以前就已打响。
一、Alvotech曾被AbbVie指控窃取修美乐商业机密
2021年3月,AbbVie(艾伯维)对Alvotech提起诉讼,声称Alvotech公司在寻求在美国市场推出自己的生物类似药时,窃取了修美乐(Humira)的相关商业机密。
- 关于修美乐
修美乐(adalimumab)是一种TNF-α(肿瘤坏死因子-α)抑制剂,能够通过与TNF-α特异性结合阻断TNF-α的致炎作用。其对多种自身免疫性疾病,如类风湿性关节炎、强直性脊椎炎、斑块型银屑病等都有作用,是自身免疫疾病领域最重磅的产品。
2012年,修美乐一举击败辉瑞的立普妥,以94.8亿美元登顶全球药物销售冠军,成为新一任的“药王”。药融云数据显示:2018年,修美乐销售额达到了203.29亿美元,这是其首次突破200亿美元大关。2019年有所下降,近两年又回升回来。2021年的销售额达到了211.97美元。据估计,2002年获批上市至今,修美乐累计销售额超1800亿美元。
截图来源:药融云全球药物研发数据库
指控表示:RongzanHo于2016年加入AbbVie,领导修美乐生产制备团队,期间接触了大量关于药物生产上游过程的关键信息和专利技术。2018年2月Rongzan Ho从AbbVie离开加入Alvotech,并在该公司担任了与在AbbVie时类似的工作——负责AVT02,也就是Alvotech的高浓度修美乐生物类似药的相关制备。
AbbVie称,Rongzan Ho在离开前曾三次试图将商业机密转移到私人电子邮件账户,前两次都被AbbVie的安全程序阻止了,但在第三次时他把原先的“有用的信息”这一文件名改成了“保持联系(AbbVie)”从而通过了安全程序。Rongzan Ho在离职信中曾表示,去Alvotech“主要是为了学习一次性生物反应器和其他新兴生物技术”,而事实上却是把机密信息带到Alvotech,以便“开发和进行AVT02的生产”,从而与修美乐竞争。Alvotech没有进行充足的时间和资源投入,独立开发其修美乐生物类似药产品生产工艺,而是“走了一条捷径”。同时,AbbVie表示,该公司就涉嫌盗窃事件与Alvotech进行联系时,Alvotech回应将调查这些指控,但事实上“从未提交任何调查结果,更不用说任何证明无罪证据,甚至否认发生过盗窃。
对于以上AbbVie的指控,Alvotech表示“强烈反对”。
对于指控内容,Alvotech并未否认招募Rongzan Ho后让其负责AVT02的相关制备工作,但指出Rongzan Ho离开艾伯维已经3年了,AbbVie自他涉嫌窃取商业机密之日起等了3年多才提起诉讼,并且没有把Rongzan Ho列为被告,这本身就匪夷所思。同时,Rongzan Ho表示他早就从电子设备中删除了所有与艾伯维及其生产流程有关的材料。
一名Alvotech的公司发言代表表示,“对该事件缺乏紧迫感致使Alvotech质疑案件背后AbbVie的动机。事实上,这可能是AbbVie长远计划的一部分,该公司希望以此延缓新兴竞争对手向患者提供更低成本的修美乐生物类似药的进度。”
另外,Alvotech也起诉AbbVie,希望结束这家制药巨头对全球最畅销药物Humira的“垄断”。在这种情况下,Alvotech指责AbbVie在该药物周围部署了“专利壁垒”,以阻止低成本竞争对手进入市场。
2022年3月8日,AbbVie宣布,已与Alvotech解决所有美国Humira诉讼。根据该决议的条款,AbbVie将授予Alvotech其在美国的Humira相关专利的非排他性许可,该许可将于2023年7月1日开始生效。
AbbVie不会向Alvotech支付任何形式的款项,Alvotech将向AbbVie支付许可其Humira专利的特许权使用费,并承认许可专利的有效性和可执行性。该决议包括驳回AbbVie与Alvotech之间的专利和商业秘密诉讼。该公司首席执行官MarkLevick表示:“我们致力于将AVT02(adalimumab biosimilar)推向全世界的患者,并将在2023年7月1日这个预期的发布日期之前做好充足准备。”

药融云数据,vip.pharnexcloud.com/?zmt-mhwz:Alvotech Holdings S.A. (Alvotech)是一家冰岛生物制药公司,2013年由Róbert Wessman创立,其总部和主要研发和制造基地位于冰岛雷克雅未克,以生产生物类似药为主,主要产品包括六种生物类单克隆抗体,用于治疗癌症、自身免疫性疾病、炎症和其他疾病。

Alvotech的目标是成为全球所有主要市场生物类似药的领先供应商。为了实现这一目标,Alvotech在过去九年中建立了一个独特而全面的大规模开发和制造生物类似药平台,在业务中投入了约10亿美元,以建立产品开发的关键要素,包括细胞系开发,工艺开发和表征,此外还有制造、临床开发和进行法规事务,内部确保最高标准的产品质量。

2022年6月7日,Alvotech与SPAC公司Oaktree Acquisition CorpII(纽交所代码:OACB),宣布达成最终合并协议。合并估值22.6亿美元,交易将为Alvotech带来2.5亿美元SPAC资金,以及1.74亿美元的PIPE融资。Alvotech于2022年6月15日完成与OaktreeII的业务合并,并于次日在美国纳斯达克开始交易,代码ALVO。2022年11月,Alvotech完成了1.36亿美元的IPO后其他轮次的融资;2022年12月,又融资了5970万美元。
Alvotech融资情况(红框内为2022年完成的融资)
截图来源:药融云投融资数据库
Alvotech拥有一支由久经考验且经验丰富的制药高管组成的世界级管理团队,他们在生物制剂和生物仿制药方面拥有深厚的专业知识,由富有远见的创始人Róbert Wessman领导,他在建立全球生物制药公司方面拥有良好的记录。
- 关于创始人

在创立Alvotech之前,罗伯特·韦斯曼(Róbert Wessman)在担任首席执行官的7年内,将原本是一家中型制药公司的阿特维斯(Actavis)转变为全球第四大仿制药公司。他还在2009年创立了Alvogen公司,作为美国的首席营销官,随后在6年的时间里将其发展成为一家全球顶级仿制药公司。在制药行业20多年的职业生涯中,他总共领导了50多次战略收购和合作伙伴关系,并在全球60多个国家建立了业务。他的领导力和成就使他成为哈佛商学院(Harvard Business School)三个案例研究的主题,分别是“罗伯特·韦斯曼和阿特维斯获奖公式”(Róbert Wessman and the Actavis Winning Formula)(2008)、“阿尔沃根”(Alvogen)(2015)和“阿尔沃根:扩大创业”(Alvogen:Scaling Entrepreneurship)(2018)。罗伯特是一名商科毕业生,曾在冰岛大学担任讲师。
二、AVT02(阿达木单抗)
AVT02(阿达木单抗)是Humira的生物类似药,用不含柠檬酸盐的制剂以100mg/mL的浓度生产AVT02。
一项针对成年受试者的双盲、随机、平行组、活性对照研究(以1:1的比例)比较了AVT02与原研药阿达木单抗(80mg,第1周皮下注射,然后每隔一周40mg)。在第16周,以1:1的比例重新随机分配接受阿达木单抗治疗的受试者,继续接受阿达木单抗治疗,或改为接受AVT02治疗,每隔一周进行一次,直至第48周。最终疗效终点为第50周。最初接受AVT02的受试者从第16周到第48周继续接受AVT02。主要终点为第16周银屑病面积和严重程度指数(PASI)评分的改善百分比。次要疗效终点包括其他时间点PASI评分的改善百分比。皮肤病学生活质量指数(DLQI)评分相对于基线的变化,以及达到“清晰”或“几乎清晰”的静态医师总体评估(sPGA)反应的受试者人数和百分比。其他次要终点包括不良事件概况、抗药抗体和中和抗体以及稳态时阿达木单抗的血清谷水平的比较。
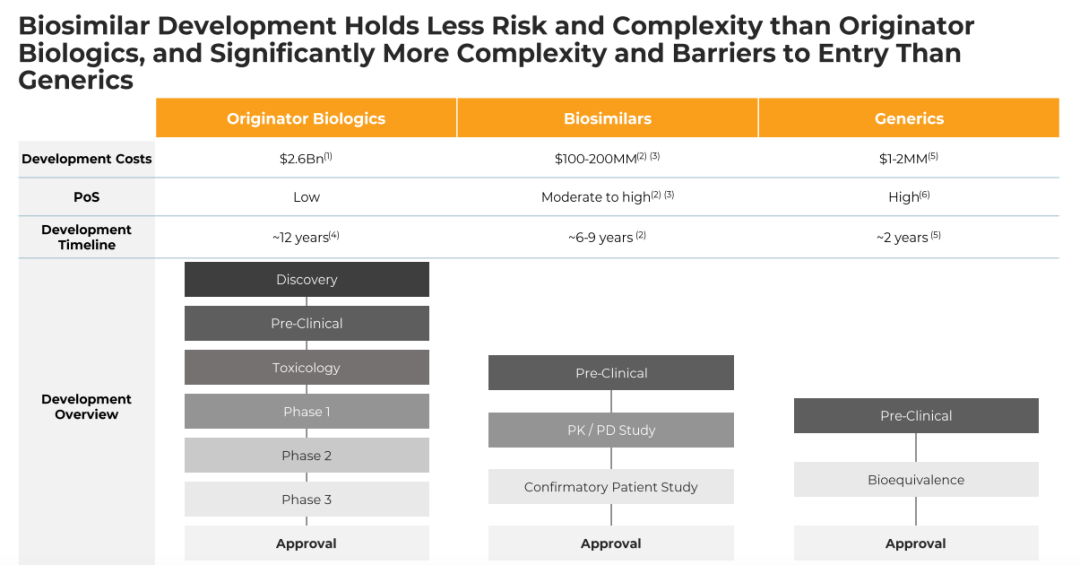
通过第1阶段/基线至第16周和第2阶段/第16周至第50周随访,PASI相对于基线的平均(±标准误差)改善百分比。使用LOCF估算受试者基线后评估的PASI改善缺失百分比。(B)中的数据与第16周时为PASI应答者(PASI50应答或更高)的受试者有关。纳入基线访视以显示改善程度,并提供随时间推移的疗效概况的直观印象。
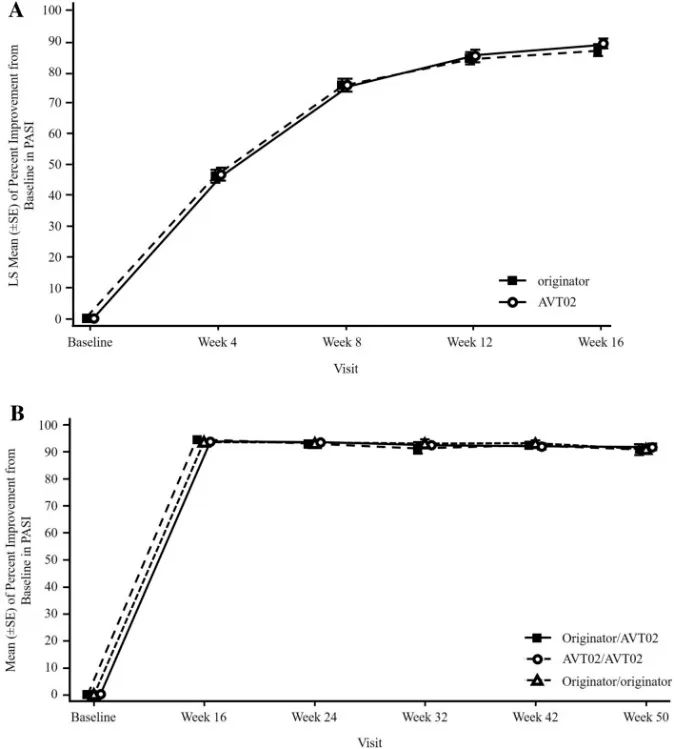
第1阶段/第4-16周和(B)第2阶段/第24-54周(安全性分析集)随访A的阳性抗药抗体(ADA)结果滴度的箱形图。未进行基线访视——排除给药前ADA阳性的受试者。
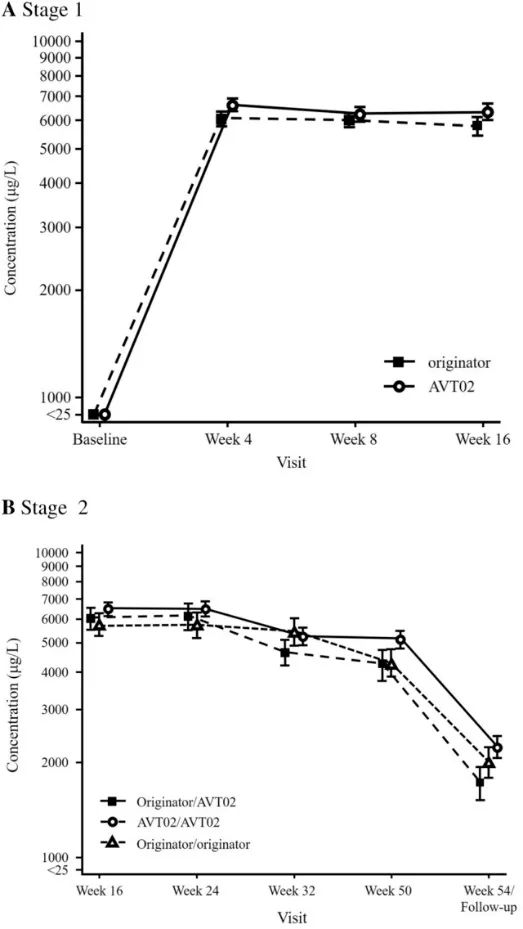
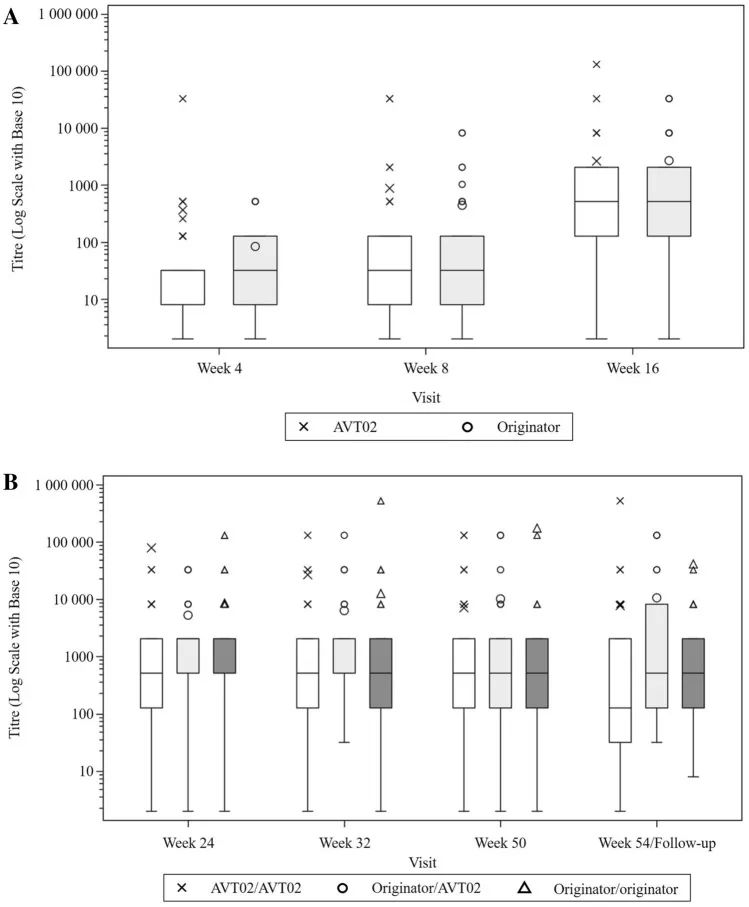
平均(±标准误差)阿达木单抗血清浓度与时间A至第1阶段/基线至第16周和B阶段2/第16-54周(安全性分析集)。所有基线统计数据都被分配了一个标称值,以便在对数标度上标绘值为0。
结果:共有413名受试者被随机分配(205名接受AVT02,208名接受发起者)。在第16周,接受AVT02治疗的受试者的PASI评分改善百分比为91.6%,而阿达木单抗原药的改善百分比为89.6%。主要终点的90%置信区间在预先定义的±10%等效范围内(90%CI-0.76至5.29;95%CI-1.34至5.88),以及第16周DLQI评分(AVT02治疗组和阿达木单抗治疗组分别为11.4分和10.6分)和sPGA(两组均有90.5%达到“清除”或“几乎清除”)的可比模式支持该评估。所有治疗组的疗效持续到研究的第50周,包括从阿达木单抗转换为AVT02的治疗组,PASI评分、生活质量评估和SPGA的改善百分比。在第16周,AVT02和原研药阿达木单抗之间的安全性、耐受性和免疫原性特征相似,并且这种情况在转换组和继续组中持续到第50周。
结论:AVT02与Humira(阿达木单抗)治疗中度至重度慢性斑块状银屑病患者时,AVT02组与Humira(阿达木单抗)组患者的第16周银屑病面积和严重程度指数(PASI)改善百分比相似。AVT02与Humira(阿达木单抗)在安全性、耐受性和免疫原性方面没有显著差异。
三、Alvotech和Stada在瑞士推出Hukyndra®
药融云数据,www.pharnexcloud.com/?zmt-mhwz:2022年9月22日,Alvotech宣布在瑞士推出Alvotech的Hukyndra®,这是一种高浓度、低容量、无柠檬酸盐的Humira®(阿达木单抗)生物类似药。Hukyndra(阿达木单抗)由德国仿制药巨头Stada在瑞士的子公司Spirig HealthCare AG销售。
Stada和Alvotech于2019年11月宣布了一项独家合作协议,该协议涵盖Hukyndra和总共六个生物类似药候选药物,涉及自身免疫、肿瘤学和眼科适应症。Alvotech负责开发和制造,而Stada负责商业化。2021年11月,Stada在27个欧盟成员国以及挪威、冰岛和列支敦士登获得了欧盟委员会Hukyndra的批准。该生物类似药现在也已在英国和瑞士获得批准。Hukyndra已经在奥地利、爱沙尼亚、法国、芬兰、德国、立陶宛、斯洛伐克和瑞典推出。
Hukyndra获批上市国家(部分)(微信搜索"药融云小程序"查看更多相关数据)
截图来源:药融云全球药物研发数据库
Alvotech首席商务官AnilOkay表示:“我们很高兴通过与Stada的合作,利用Alvotech作为专用端到端生物类似药开发和制造平台的优势,扩大患者获得具有成本效益的生物制剂的机会。”

Alvotech目前没有直接销售和分销能力,因此,Alvotech选择通过与多个区域合作伙伴建立合作伙伴关系来营销推广和商业化其产品。例如,在美国,Teva负责AVT02、AVT04和AVT06等候选产品的商业化,在欧洲经济区,Stada负责AVT02、AVT04和AVT06等候选产品的商业化。
- 关于Hukyndra
Hukyndra在用于自我给药的安全装置中提供80mg/0.8mL和40mg/0.4mL两种形式,在预填充的自动注射笔中提供40mg/0.4mL两种形式,旨在方便患者使用。Hukyndra是一种单克隆抗体,是一种抑制肿瘤坏死因子的Humira®(阿达木单抗)的生物类似药。
- 关于Stada
Stada总部位于德国巴特维尔贝尔,该公司专注于三大支柱战略,包括仿制药、专科药物和消费者保健产品。在全球范围内,Stada在大约120个国家销售其产品。2021财年,Stada实现集团销售额32.5亿欧元,报告息税折旧摊销前利润(EBITDA)为欧元7.7亿欧元。截至2021年12月31日,Stada在全球拥有12,520名员工。
四、产品研发管线


管线亮点(截至2022年8月31日):
- AVT02在加拿大获得批准:加拿大卫生部授予AVT02上市许可,为其在加拿大上市铺平道路
- 与Biosanapharma签订独家全球许可协议,这是一种与Xolair®(Omalizumab)类似的生物制剂
- 扩大日本市场的合作伙伴关系:授予富士制药公司一种未公开的生物类似药的独家商业权利,该生物类似物目前正处于Alvotech公司的早期开发阶段,该协议使该公司合作的拟议生物类似药总数达到6个
- FDA接受了AVT02的BLA,包括生物相似性和可互换性:Alvotech是唯一一家已知的拥有Humira®的高浓度生物类似物候选药物的公司,该公司已完成了一项转换研究,以支持高浓度阿达木单抗的拟议可互换名称;目标日期设在2022年12月
- 宣布AVT04 PK相似性研究的阳性结果:结果证明AVT04(Ustekinumab)与参考产品STELARA®具有生物等效性
- 宣布AVT04临床患者研究的积极结果:结果证明AVT04(Usetekinumab)和参考产品STELARA®之间的治疗等效性。Alvotech是第二家披露STELARA®生物类似物患者研究阳性结果的公司
- 在加拿大与Jamp Pharma合作推出AVT02:独家加拿大合作伙伴Jamp Pharma推出了AVT02(阿达木单抗),商品名为Simlandi™
- 在欧洲与STADA合作推出AVT02(不包括欧盟成员国)
五、财务状况
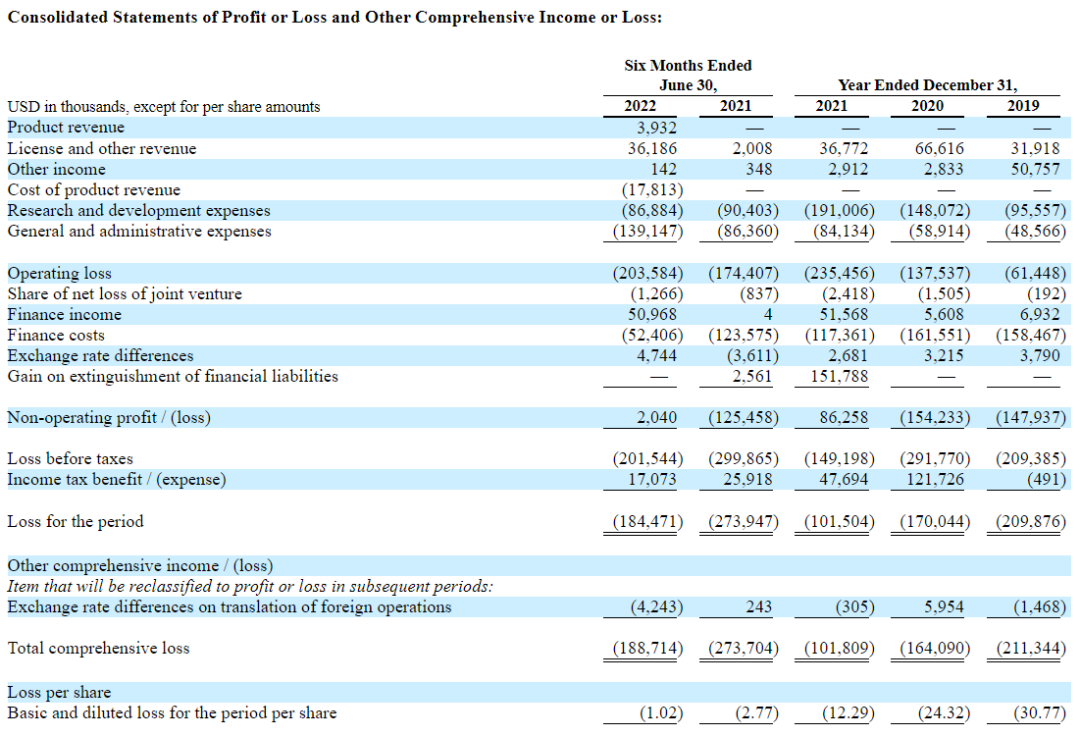

数据显示,2021年财年该公司收入金额为3677.2万美元,收入来源于许可协议与其他收入,未获得来自产品的盈利;研发支出1.9亿美元,一般及行政支出8413万美元;综合损失总额1.02亿美元。
2022年8月31日,Alvotech公布2022年半年报。截至2022年6月30日,公司拥有1.28亿美元的现金和现金等价物;该公司借款和其他金融负债总额为5.64亿美元,包括1.21亿美元的流动借款部分;2022年上半年收入为4010万美元,而2021年同期为200万美元,该收入包括在部分欧洲国家和加拿大销售AVT02的390万美元产品收入,以及完成的与AVT04主要临床计划相关的里程碑所产生的3620万美元的许可和其他收入。
研发费用为8690万美元,而2021年同期为9040万美元。这一减少主要是由于商业前制造成本;一般和行政(G&A)费用为1.391亿美元,而2021年同期为8640万美元。这一增长主要是由于8340万美元的非现金股票上市费用和因业务合并而确认的2100万美元的交易成本。这些费用被与长期激励计划相关的费用减少5570万美元所抵消;净亏损为1.845亿美元。
在2022年Q3,Alvotech实现营收1910.8万美元。
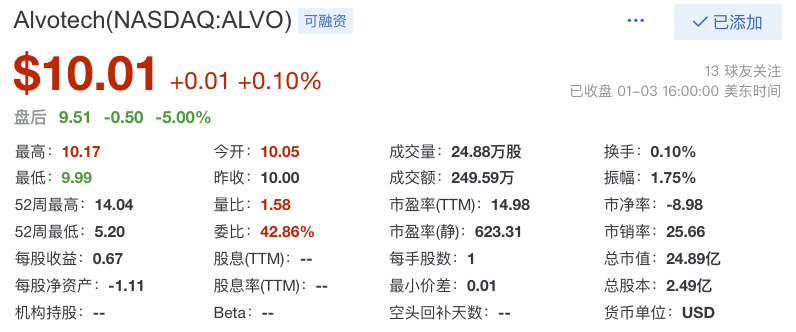
下图为Alvotech最近股票收盘价10.01美元/股,总市值约24.89亿美元(约合172亿人民币)(2023年1月3日收盘)。
参考来源:
NMPA/CDE;
药融云数据库,vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露(正文图片除标注外,均来自企业官方);
https://www.alvotech.com/;
https://investors.alvotech.com/news-releases/news-release-details/update-us-regulatory-status-avt02-alvotechs-proposed-high;
https://investors.alvotech.com/news-releases/news-release-details/alvotech-completes-597-million-private-placement;
https://pubmed.ncbi.nlm.nih.gov/34657274/;
AlvotechReports First Half 2022 Financial Results and BusinessUpdatehttps://investors.alvotech.com/node/7281/pdf;
https://www.biopharmadive.com/news/humira-abbvie-biosimilar-competition-monopoly/620516/;
https://new.qq.com/rain/a/20220916A0AGEO00;
FDAholds back Alvotech’s Humira biosimilar over manufacturing issues |BioPharma Dive
https://www.biopharmadive.com/news/Alvotech-humira-biosimilar-fda-reject-crl-manufacturing/631213/;
https://view.news.eu.nasdaq.com/view?id=bef874c3542dbad4d0f2c7fb840fedfb3&lang=en;等等。
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论