
新药的研发是一个漫长,昂贵且充满风险的活动,一般来说可能需要十年以上的时间,10-20亿美元的投入,犹如千军万马过独木桥般充满着不确定性与艰辛,最终造就一个新药的诞生,如下图可见,尽管一个候选化合物进入临床试验仍旧有90%以上概率失败。从近几年接触国内的新药开发来看,即使是me too或者me better的药物,也感觉临床推进的越快,越是很早宣告失败。对于新药研发的进度,越早推进也能越早发现其中的风险,以避免进入临床研究后期发现具有极大缺陷,造成更大的损失。极早的宣告失败可能也不是坏事。
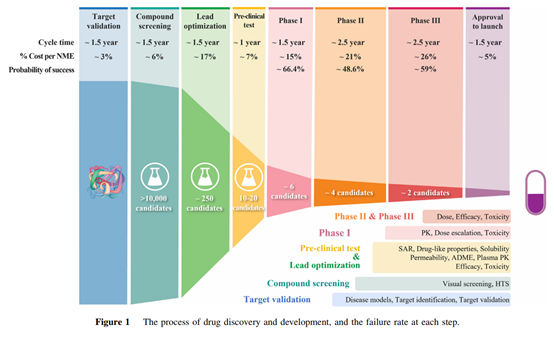
引用自参考文献1
新药开发最终的目的是早早的上市,对于药企来时,可以尽快的收回成本,避免仿制药来的太快;对于病人来说,也能早早接受治疗,免于病痛的折磨。如何更快的推进新药的开发呢,这是一个十分庞大问题,需要研发不同的研究部门联合协作,制定切实可行的研发策略。其实,我们也看到一些医药巨头做出了一些研发策略上的转变。
1988年,一篇披露药物开发失败原因的文献表明大约39%的药物因生物药剂学性质(PK和生物利用度)较差而开发失败。在1990年代初之前,药物研发过程大体上是单向的。药物发现阶段更加关注药物分子是否是与蛋白质靶标作用强且具有特异性的配体。有前途的分子将在动物体内进行体内药代动力学(PK)、功效和安全性研究。当候选化合物进入开发阶段,对化合物进行物理化学性质表征并进行早期制剂处方工艺研究,制备具有一定稳定性,可制造性并在人类体内表现出最佳PK(即吸收、分布、代谢和排泄)的药物产品。申报IND后,该产品将在人体进行临床试验,而后开发小组将注意力转向最终以商业规模生产该药物的制造过程。这种单向的药物研发模式称之为Development 1.0。此开发模式主要特点是候选化合物分子未进行理化性质表征已经确认其将进行后续开发,在真正开发阶段即使其稳定性较差,溶解度较低,生物利用度较低,数据已经无法改变,生米煮成熟饭。开发小组有时不得不硬着头皮制定开发策略,当然比较差的分子特性导致不可避免的劣质药物产品的产生。许多临床项目被推迟,或者更糟糕的是,完全失败。大部分候选药物没有通过整个开发过程而“胎死腹中”,其中化合物的低水溶性情况已经泛滥成灾。难溶性药物越来越普遍,可能与以下几个方面有关:
- 组合化学和高通量筛选模式在新药筛选中的应用(通常在非水介质(或混合溶剂介质)中)可能发挥了作用。
- 对提高效力的追求,加上受体结合至少部分由疏水相互作用介导的认识,进一步放大了候选药物具有有限水溶性的可能性。
- 探索前所未有的药物靶点(其中一些与intracellular signaling pathways, lipid processing architecture, or highly lipophilic endogenous ligands相关)扩大对高度亲脂性、水溶性差的候选药物的产生。
随着对Development 1.0造成新药开发折戟沉沙根源的发掘,继续探索性的药物开发模式-Development 2.0。科学家在临床前开发中的核心能力—包括物理化学、过程化学、工程、药剂学和材料科学—带入发现阶段。在确定单个分子结构之前,临床前专家将研究物理化学和生物药剂学特性,甚至评估可制造性和放大规模的潜力,需要关注的药物性质如图2所示。只有这样,一种化合物才能进入全面的临床前开发阶段。换句话说从发现到开发的转变变成双向的:分子像以前一样向前进入开发—但首先,下游获得的专业知识被反馈给发现团队,并在(或不久之前)候选化合物选择阶段决定是否继续。

图2 化合物分子常见性质(引用自参考文献2)
Development 2.0打通了发现与开发团队双向交流的通道,有助于发现可以做到构效关系(SAR)与结构-性质关系(SPR)平衡的候选化合物。最近,许多公司已经开始在发现的先导和先导优化阶段通过高通量、小型化或自动化的物理化学筛选来扩大这些研究的规模。候选化合物的众多性质获得表征,包括物理化学性质,生物学性质以及PK,毒性。将表征获取的药物的性质,这些药物数据可以根据一些类药性规则,如Lipinski著名的“5法则”、成药性和生物药剂学分类系统,推断其后续开发的可能性与困难性。
类药五规则(rule of five)也称为Lipinski规则,其内容如下:一个小分子药物中要具备以下性质:
- 1、分子量小于500;
- 2、氢键给体数目小于5;
- 3、氢键受体数目小于10;
- 4、脂水分配系数小于5;
- 5、可旋转键的数量不超过10个。
如果一个化合物违背类药五规则中的2个或2个以上的规则,则该化合物成为口服药物的可能性较低。
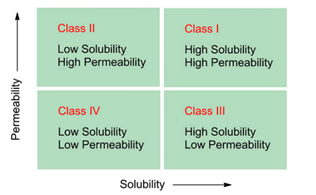
生物药剂学分类系统(BCS)
图3 药物溶解度与渗透性构建生物药剂学分类系统。溶解度-渗透性关系对口服药物吸收的进一步应用是最初由Amidon等人开发的生物药剂学分类系统(BCS)。BCS的原理在其他地方有很好的描述药物分子的溶解度和渗透性能。根据BCS,I类分子是那些同时具有高溶解度和高渗透性的分子(因此口服吸收可能很少出现问题);II类化合物是那些具有低溶解度和高渗透性的化合物(其中溶解度是吸收的主要限制);III类化合物具有高溶解度但低渗透性(吸收受限于膜渗透而不是溶解度);IV类化合物是溶解性差和渗透性差限制药物吸收的化合物。(引用自参考文献3)
发现团队在对化合物进行表征,有助于确定进入开发阶段化合物并提前获取化合物开发中可能存在的问题。尽管如此,临床前和临床开发的后期阶段可能会带来早期开发专家可能无法识别的问题。例如,众所周知,专家也很难在未进行临床试验之前,对人体生物药剂学特性进行准确预测,即使已经出现理论想通过体外及动物实验的结果去预测首次人体临床药物体内吸收情况,如PKPB,DCS等。新药早期制剂的开发与后期商业化生产的批量具有指数级别的差距,无法预测该产品在放大中可能遇到的诸多问题。
虽然采用Development 1.0的制药公司曾经花费巨大的努力试图开发不可开发的分子,徒劳而无功;但是,是不是采用Development 2.0模式就能避免这种情况的发生呢?双向沟通式的Development2.0仍旧具有其缺点:原本很有希望的分子—例如,可能对其靶标具有高结合亲和力和特异性的分子——由于稳定性差、生物药剂学特性或放大潜力而被淘汰。其中一些失败可能为时过早。
Development 2.0的横空出世让制药研发团队重新思考药物研发流程的合理性,但是仍然考量不够全面。临床前和早期开发团队的所获取药物信息应扩大到包括药物开发每个阶段。决策者不仅应该能够认识到分子是否可以很容易地制成药物制剂,而且还应该能够识别其他固态形式转变在新药开发中的巨大作用,即通过固态形式的变更使成药性差的药物重新回到研发赛道中。这些都需要决策者应该能够估计生物药剂学特性,并为扩大生产中的任何困难提前做好准备。简而言之,研发管理必须进行转化思考。他们必须注意发现阶段的分子在达到其靶标之前必须经历的许多演变——因为它被配制、制造、储存、给药、吸收、代谢和运输。他们必须问:
- 这种分子能否进入其生命周期的每个后续阶段,而不仅仅是进行早期临床处方开发?
- 选择哪种固态开发形式(如晶态或无定形态)进行开发能够保证体内吸收?
- 药物成分的开发成胶囊或片剂?
- 该药物分子能否在货架期会发生怎样的变化?
- 该药物分子在人体内如何进行吸收、分布、代谢、排泄?
- 该药物制剂可以大规模生产吗?
开发阶段获取的有关药物的信息将服务于药物开发所有阶段,直至人类给药,此转化药物开发过程称为Development 3.0。Development 3.0是一个通过设计下游可开发性来减少有治疗前景的化合物被浪费的可能性的过程。迫切需要对发现与开发之间的关系进行如此彻底的重新思考。Development 3.0减少了下游开发过程中出现意外的可能性,使管理团队能够就推进哪些分子做出最谨慎、最明智的决定。Development 3.0还可以防止有前途的分子一开始就失败。在某些情况下,对后期开发问题的早期认识可能会使药物化学家回到化合物的发现。在其他情况下,Development 3.0拯救了有希望的化合物,否则这些化合物会被淘汰,比如水溶性差的强效化合物,如果可以以其他固态,包括多晶型、共晶、和无定形分散体形式进行开发,它仍可能成为临床上可行的药物。可开发性中的一些问题可能会在临床前开发过程中得到纠正,当然,至于Development 3.0是否为最佳药物开发模式,相信随着科学技术的不断发展,还会有新的模式出现。
小结:
新药研发是一个特别庞大的工程,历经时间之前,牵涉人员、部门之多,需要切实制定适宜的研发策略,推进新药的快速开发。从上文,我们也可以知道,新药开发模式也是摸着石头过河,不是一蹴而就的,不断在实践之中去总结经验与教训,然后重新出发。新的历史时期,我们相信会有更多高新技术出现,应用在新药开发的征程中,去推进新药的发展,试着去学习与应用,试着去接受新鲜的事物,试着鼓励创新,试着去革新或者革命。工作以后,不由得觉得国内新药研发基础建设仍旧具有很长的路要走。不禁想问,国内top级的医药企业,是否具有top级的研发团队,top级的管理团队,top级战略与战术,top级人才管理方法,top级……?哈哈哈……参加工作那么久,感觉自己还挺水的。上文主要整理翻译自参考文献4,如有不妥之处,还请查看原文。
以红楼梦中下诗以作结:
满纸荒唐言,
一把辛酸泪。
都云作者痴,
谁解其中味?
参考文献:
1. Why 90% of clinical drug development fails and how to improve it?
2. Drug-like Properties Concepts Structure Design and Methods; from ADME to Toxicity
3. Strategies to Address Low Drug Solubility in Discovery and Development
4. Pharmaceutical Amorphous Solid Dispersions
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论