
国内最新获批临床的新药有哪些?获批上市的新药又能给哪些患者带来新的治疗新选择?解析行业热点事件、实时获取每月获批临床品种全球上市及研发进展、全局分析相关靶点,尽在药融云月报。
根据药融云《7月全球在研新药与靶点月报》数据统计,2022年7月共有141个化药1类新药受理号获CDE承办(含补充申请31个),其中国产77个,进口33个,从申请类型来看,包括临床申请107个,上市申请2个,涉及72个品种,86家企业;共有58个1类治疗用生物制品受理号获得承办(含补充申请11个),其中国产33个,进口14个,从申请类型来看,主要为临床申请(47个),涉及47个品种,64家企业。
7月共有78款新药获批临床(共计个120受理号),其中包括41款化药,36款生物制品, 1款中药。
2022年7月国内获批临床新药一览表(部分)
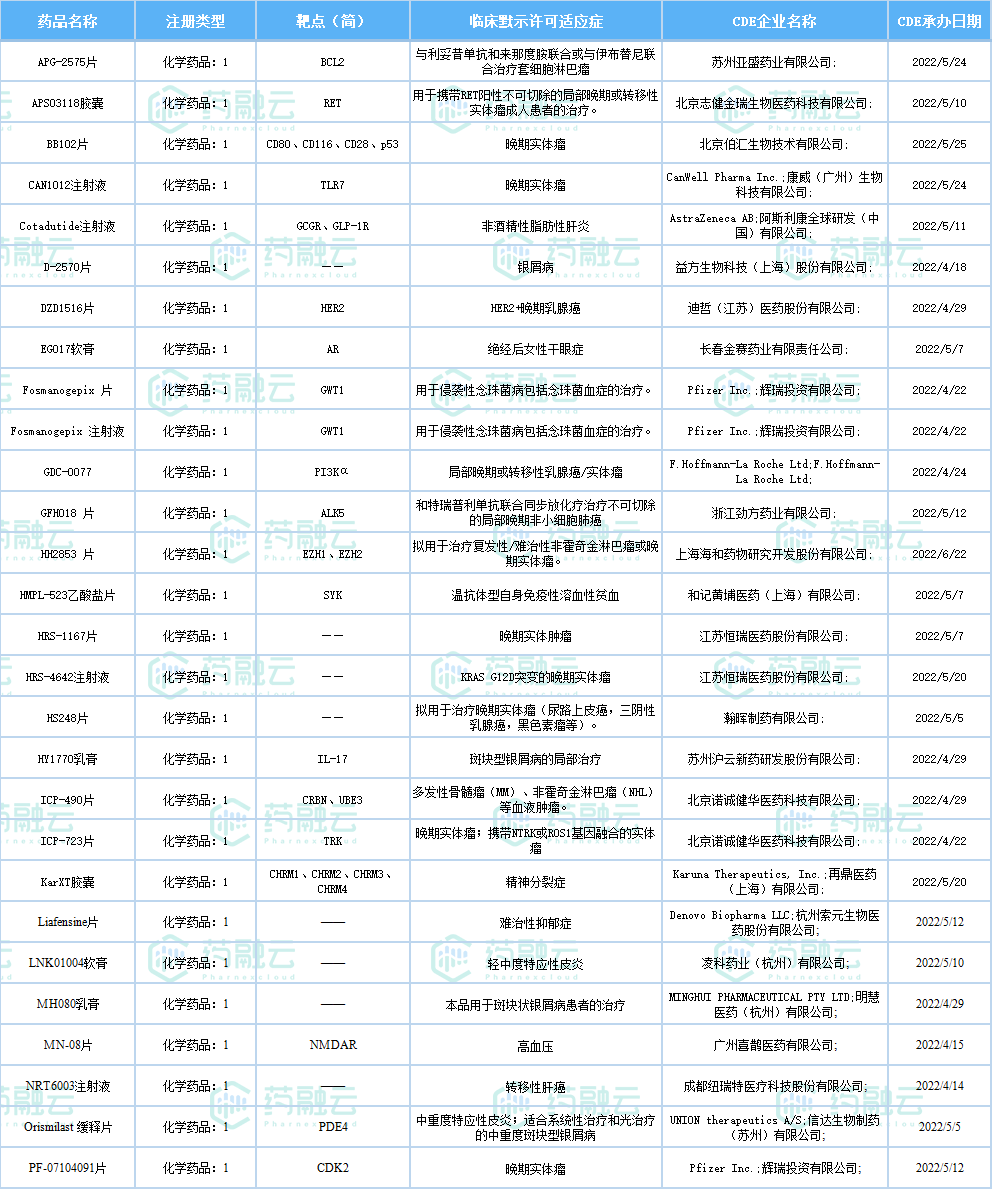
想要获取完整表格内容可通过药融云全球研发数据库进行下载,或者关注药融云公众号(gh_d20f87bd52d9)回复“报告”关键词进行领取。
7月,共有3款新药获批上市,分别是先声药业的注射用盐酸曲拉西利、罗氏的恩曲替尼胶囊、乐普生物的普特利单抗注射液。
2022年7月国内获批上市的新药
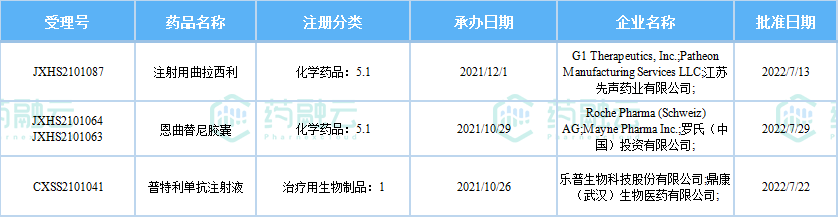
备注:(1)此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类(境内外均未上市的创新药)、5.1类(境外上市的原研药申请在国内上市);生物药主要为NMPA首次批准的国产及进口生物药。获批上市新药不包括生物类似物,新适应症、新剂型。
1.全球首款具有全系骨髓保护功效药物:注射用盐酸曲拉西利
注射用盐酸曲拉西利(商品名:科赛拉)是先声药业与G1 Therapeutics合作研发的一款CDK4/6抑制剂,用于既往未接受过系统性化疗的广泛期小细胞肺癌患者,在接受含铂类药物联合依托泊苷方案治疗前预防性给药,以降低化疗引起的骨髓抑制的发生率。
曲拉西利为全球首个且唯一具有全面骨髓保护功效的药物,是可以减少CIM的一种全新疗法,曾获美国FDA突破性疗法认定,并于2021年2月在美国上市。在2022版《CSCO小细胞肺癌诊疗指南》中,曲拉西利被列入广泛期小细胞肺癌(SCLC)一线治疗及复发SCLC二线治疗中,化疗前预防应用的II级推荐(2A类证据)。
曲拉西利是一款高效、选择性、可逆的CDK4/6抑制剂,可以诱导造血干/祖细胞(HSPCs)及淋巴细胞暂时停滞在G1期,降低化疗药物对骨髓细胞的损伤,起到多谱系的保护作用;小细胞肺癌的肿瘤细胞因对CDK4/6不敏感而不会受到其抑制。
曲拉西利就像一张网,将正常细胞拦截在化疗药物之前而将癌细胞漏过,保证化疗疗效的同时起到骨髓保护作用。曲拉西利的上市,解决化疗导致的骨髓抑制剂这一长期面临的困扰,为更多患者带来治疗希望。
注射用盐酸曲拉西利-药品批文信息(部分)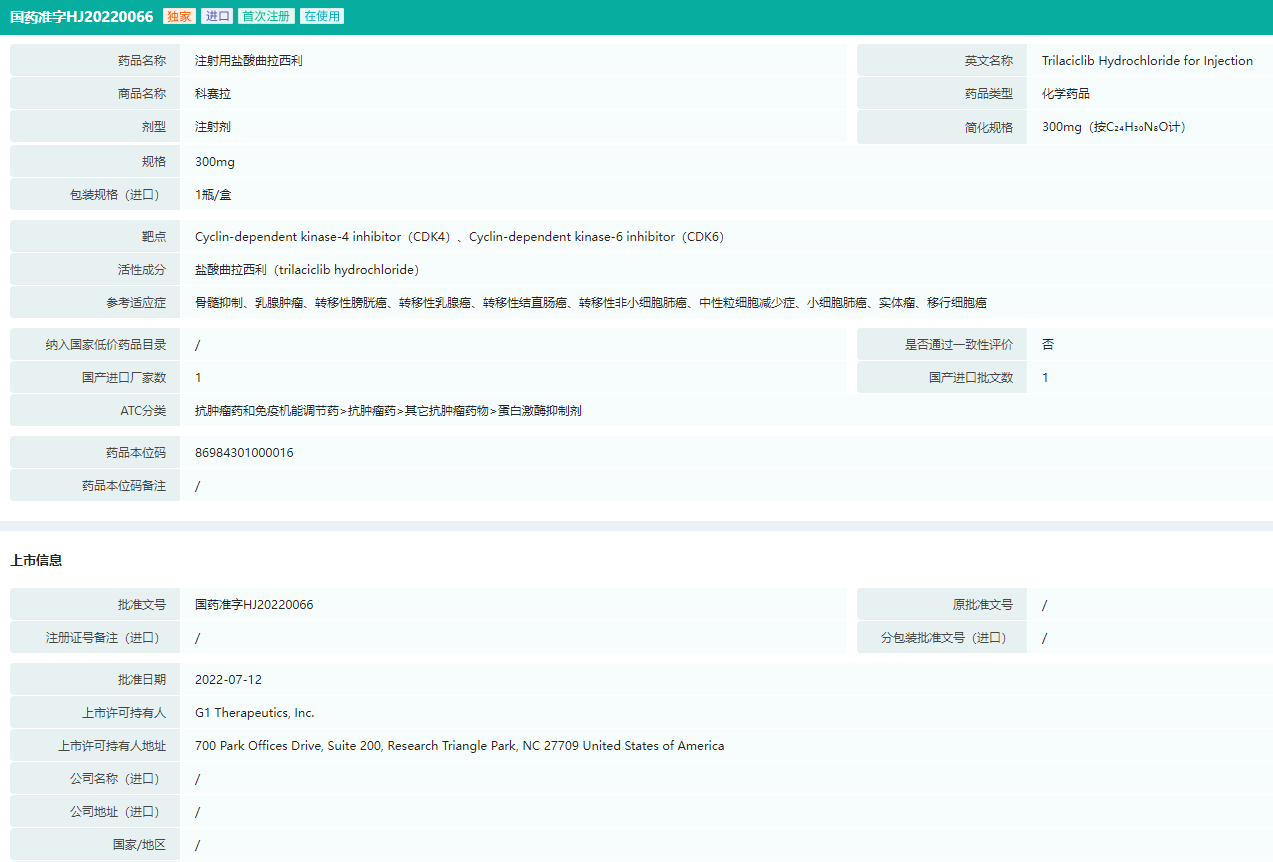

图片来源:药融云中国药品批文数据库
2.“不限癌种”的抗癌疗法:恩曲替尼胶囊
7月29日,罗氏(Roche)公司的泛肿瘤抗癌药恩曲替尼(Entrectinib,商品名:罗圣全®/ROZLYTREK)正式获批上市,用于治疗NTRK融合阳性局部晚期或转移性实体瘤患者。
恩曲替尼是一款靶向ROS1/ALK/Trk的小分子抑制剂,且不分年龄、不分癌种、有效率高的广谱抗癌药,恩曲替尼因针对的靶点多,意味着它能对症的癌症种类也会增多。它是临床上唯一一种被证明针对原发性和转移性CNS(中枢神经系统)疾病具有疗效的TRK抑制剂,并且没有不良的脱靶活性,更多的国内患者即将受用。
自2019年,恩曲替尼陆续在日本、美国、欧盟等地获批上市,用于治疗NTRK融合基因阳性实体瘤患者,以及ROS1阳性晚期非小细胞肺癌患者,是FDA批准的继Keytruda和Vitrakvi之后第三款“不限癌种”的抗癌疗法。
恩曲替尼在不同国家/地区的研发状态(部分)

图片来源:药融云全球药物研发数据库
神经营养性酪氨酸受体激酶(NTRK)是目前首个被发现并被认可的全癌种共发的可用药的突变基因,在多种肿瘤中都有发现,在常见肿瘤肺癌、结直肠癌中的发病率低于5%,但多出现于成人和儿童实体瘤中,包括乳腺类似物分泌癌(MASC)、甲状腺癌、结肠癌、肺癌、胰 腺癌、及各种肉瘤等。
不限癌种的NTRK成为近年来大热的肿瘤治疗靶点,NTRK也正式被写进众多癌种的临床指南中,在NCCN指南中,NTRK成为非小细胞肺癌、乳腺癌、肝胆肿瘤、胃癌、肠癌、黑色素瘤等实体瘤推荐检测基因。
3.第8款国产PD-1抗体:普特利单抗注射液
7月22日,乐普生物的首款创新型生物药抗PD-1单克隆抗体——普特利单抗注射液(普佑恒™)获批上市,适用于不可切除或转移性的高度微卫星不稳定型(MSI-H)或错配修复缺陷型(dMMR)的晚期实体瘤患者:①既往经过氟尿嘧啶类、奥沙利铂和伊立替康治疗后出现疾病进展的晚期结直肠癌患者;②既往至少一线治疗后出现疾病进展且无满意替代治疗方案的其他晚期实体瘤患者。
普特利单抗注射液审评时间轴(历时269天)
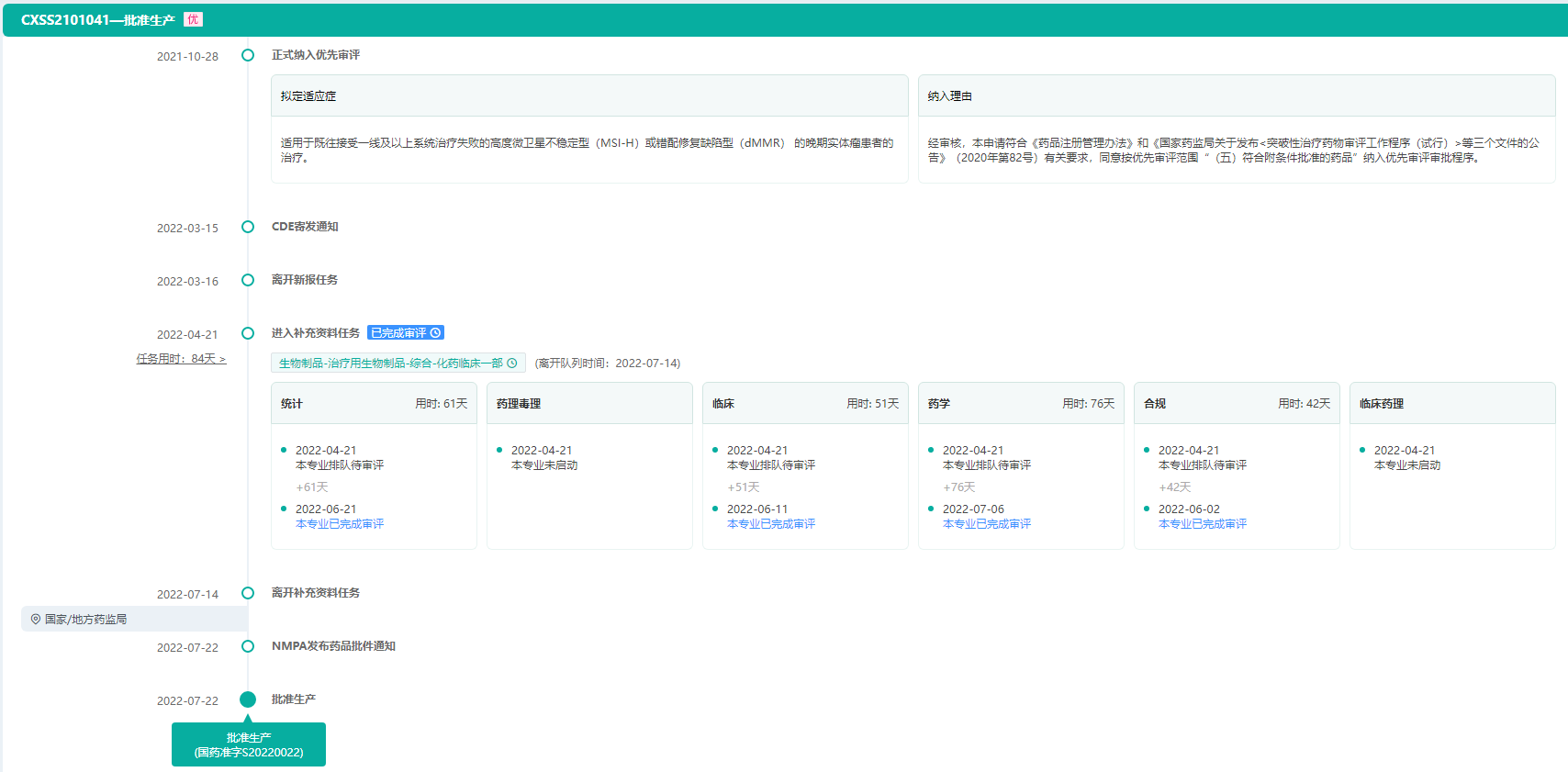
图片来源:药融云中国药品审评数据库
乐普生物的普特利单抗注射液也成为了第8款获批上市的国产PD-1抗体,同时也是国内获批的第14款PD1/PD-L1单抗。它是2018年乐普生物收购泰州翰中的PD-1产品,属于差异化设计的人源化单克隆抗体,在IgG4的Fc引入了S254T、V308P、N434A突变以延长半衰期。一期临床中,单次给药半衰期为17-24天,稳定后半衰期为18-38天。
据药融云数据库显示,乐普生物分别于2021年6月和2021年10月向NMPA提交了普特利单抗的2项适应症上市申请,分别用于治疗黑色素瘤和MSI-H/dMMR实体瘤。
2021年7月5日,普特利单抗二线治疗黑色素瘤的上市申请获得CDE正式承办受理。目前处于审评审批阶段。
普特利单抗二线治疗黑色素瘤审评情况
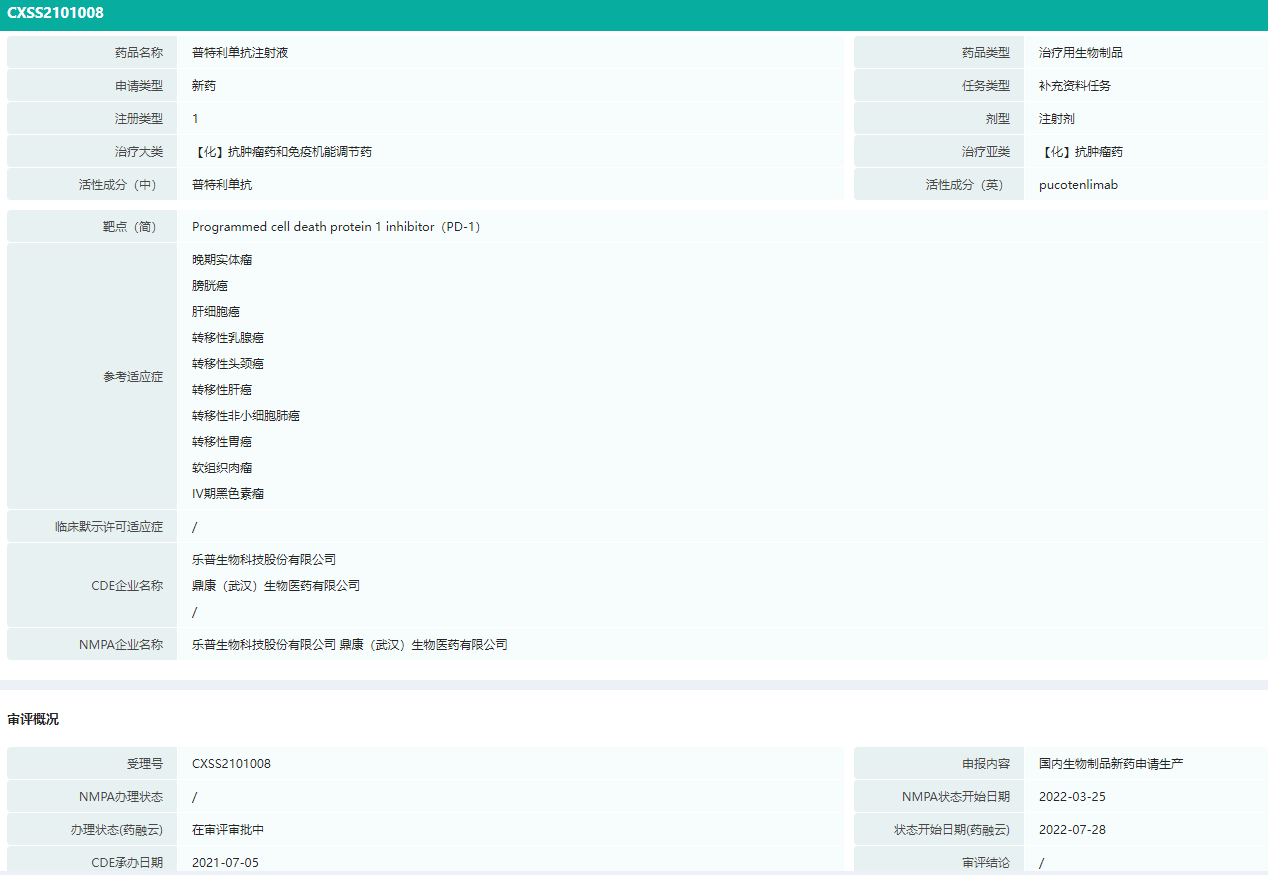
图片来源:药融云中国药品审评数据库
2021年10月,普特利单抗的MSI-H/dMMR实体瘤上市申请被CDE纳入优先审评,具体适应症为:适用于既往接受一线及以上系统治疗失败的MSI-H或dMMR的晚期实体瘤患者的治疗。普特利单抗注射液的上市,将为更多中国患者带来肿瘤免疫治疗新选择。
结语:
药融云咨询团队联合药学数据分析团队开辟了《全球在研新药与靶点月报》专栏,专栏主要内容包括分析监测每月新药注册申报和药物研究进展,追踪国内医药大健康投融资与发展动向,关注国内企业创新药出海/跨国企业在华新药布局动态,解读热门/潜力靶点、疗法、适应症领域最新重大事件。
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论