
引言
一直以来,神经细胞外β淀粉样蛋白沉积引起阿尔兹海默症的观念深入人心,围绕减少β样淀粉蛋白的药物研究也多如牛毛,但近日,美国纽约大学格罗斯曼医学院联合内森克莱恩研究所的一项研究颠覆了这一观点,其发表在nature neuroscience (自然·神经科学)上的文章认为神经细胞内溶酶体的“酸化”障碍才是引起胞外β样淀粉蛋白增多,进而导致阿尔兹海默症(AD)的元凶。

AD与自噬溶酶体功能障碍
研究发现,阿尔兹海默症的发生,起因于神经细胞自噬溶酶体功能障碍,更准确地来说,是“酸化”障碍,这一切都要从自噬溶酶体的功能说起。
自噬溶酶体由自噬泡与溶酶体融合形成,像一个自动化的细胞垃圾处理系统,自噬泡将细胞内损伤的蛋白质、核酸、细胞器等运输到溶酶体,由溶酶体内部的酶对这些物质进行降解。正常情况下,溶酶体的内部呈酸性(4.2-5.3),其内部的酶只有在这种酸性环境中才能正常工作。
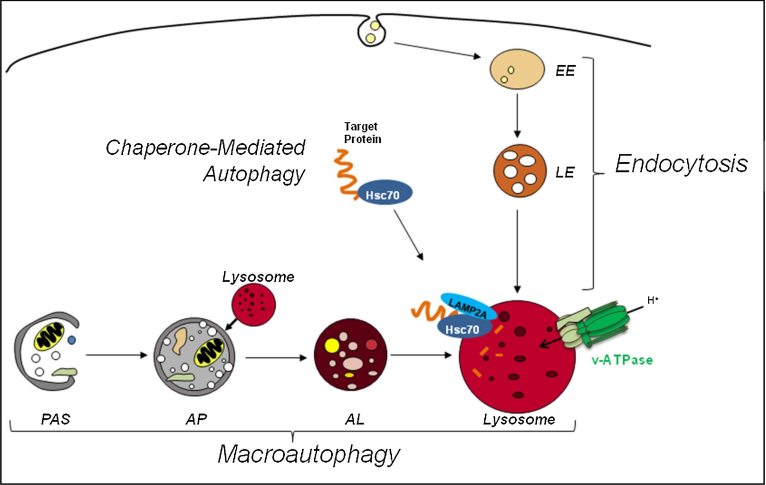
溶酶体自噬和内吞途径。图源:Disordersoflysosomalacidification—Theemergingroleofv-ATPaseinagingandneurodegenerativedisease
一旦溶酶体酸化障碍,包括β淀粉样蛋白和β样淀粉样前体蛋白(APP)代谢物APP-βCTF在内的蛋白难以被清除,只能聚集在溶酶体内,而自噬泡还会源源不断地向溶酶体输送细胞垃圾。随着溶酶体内的细胞垃圾越积越多,就会承受不住而破裂,进一步引起细胞解体,将β样淀粉蛋白释放入组织环境,引起阿尔兹海默症的典型特征“细胞外斑块”。
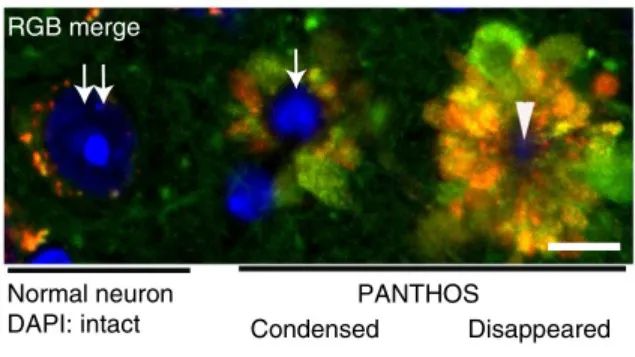
而这一理论在阿尔兹海默症模型小鼠得到验证,在出生后5个月,大脑新皮质区域90%的自噬溶酶体就已经出现酸化障碍,比它们出现脑部淀粉样斑块的时间(10-12个月),早了至少5个月。而在早发型阿尔兹海默症模型5xFAD小鼠身上,这一时间更早,在2月龄的5xFAD小鼠脑部就可以发现酸化障碍的自噬溶酶体以及神经细胞退化的现象。
溶酶体酸化障碍关键因素
溶酶体的酸化调节主要依赖质子泵v-ATPase和溶酶体膜中由离子转运蛋白介导的阴离子和阳离子的运动。质子泵v-ATPase是一种ATP依赖性质子泵,可以将细胞质中的H+离子泵入溶酶体内维持酸性环境。但v-ATPase是一种电泵,其产生的电梯度必须通过阳离子的外流和/或阴离子的导入来消散,以这样才能保持持续的H+导入。
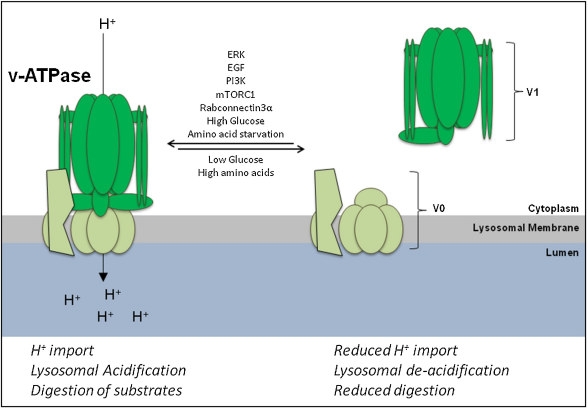
v-ATPase 通过ATP依赖性质子在溶酶体膜上的运输促进溶酶体的酸化。
与此相应,在早发型阿尔兹海默症模型5xFAD小鼠出生后6个月时,它们神经细胞溶酶体上的质子泵vATPase活性和同龄的野生型小鼠相比明显下降(65.6 ± 4.1%),到了第12个月时,更是连一半都不到(45.3 ± 3.7%)。
展望
根据上述研究,只要恢复神经细胞内溶酶体的酸化功能,就可能治疗阿尔兹海默症。有研究人员在果蝇身上的试验发现,果蝇中v-ATPase亚基的功能丧失突变会引发蛋白质降解失败和衰老依赖性神经变性,也许这就是下一代阿尔兹海默症药物的研究方向。
国内也有团队做出了不同的选择,南开大学的团队开发了一种改性溶酶体作为制备治疗蛋白错误折叠或加工类疾病药物,通过向小鼠尾静脉注射脑部小胶质细胞来源溶酶体,促进阿尔兹海默症小鼠脑内表达的毒性蛋白的降解,并且此溶酶体并无失活也无神经毒性,这也是一种治疗方案。
参考来源:
[1] Faulty autolysosome acidification in Alzheimer’s disease mouse models induces autophagic build-up of Aβ in neurons, yielding senile plaques
[2] Disorders of lysosomal acidification The emerging role of v-ATPase in aging and neurodegenerative disease
[3] 一种改性溶酶体作为制备治疗蛋白错误折叠或加工类疾病药物的应用
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论