
中国和印度同为仿制药大国。经过多年的发展,我国制剂产能位居世界第一,消费结构以国内为主,国际市场份额占比很小。根据中国医药保健品进出口商会的数据,我国 2020 年制剂出口 49.3 亿美元,其中出口至美国制剂为 6.8 亿美元。印度号称“世界药房”,为全球最大仿制药出口国,国际化优势明显。据印度药品出口促进会(Pharmexcil)数据显示,2020-21 财年,印度仿制药共出口 188.5 亿美元,其中美国约占仿制药出口总量的 3 成左右。
美国既是世界最大的仿制药市场,也是全球质量标准最高的市场,而且中印制剂出口的第一大市场都是美国。本文拟以美国市场为例,从文化融合、产业发展逻辑、产品走出去、首仿药及专利挑战、国际并购、产业链生态六个方面对比分析中印仿制药国际化的差距。
一、历史形成的文化融合差异
根据 2018 年美国人口统计,在美亚裔人口中,最大的是华裔,508 万人,印度裔其次,412 万。印度官方语言为英语,受英国长期影响,其思想、制度、文化与美国社会具有天然的融合性,在美国政界、商界都有巨大影响。美国现任副总统哈里斯即为印度裔,拜登在上任之初提名了多达 20 位印度裔政府官员,其中美国卫生局局长穆西即位列其中。相对而言,华裔性格比较内敛,行事低调,参政热情不太高涨,近年来在美国政府任职的,只有目前的国防部副部长徐若冰、小布什时期劳工部长赵小兰、驻华大使骆家辉等寥寥数人。
有个有趣的现象,在美国集中化的印度裔社区极少且规模小,但华裔社区,却在全美遍地开花,甚是流行。华裔在文化上融入美国主流社会相对迟缓,在医药行业中更多从事的是研发方面的工作。印度人性格外向,善于表达,特别热衷管理, 不少跨国制药企业的高管甚至CEO 都有他们的身影。
印度在语言,文化等方面与美国客观存在融合优势,一定程度上为其在美国的国际化发展可以赋能。而我们对于美国文化和法制的理解相比存在较大的差异,这些差异一定程度会影响企业和个人在美国的发展,甚至是产品的申报和销售成功。
二、产业发展逻辑的差异
20 世纪 70 年代,印度政府陆续出台“取消医药、化学品专利”“限制外资企业的股份”“提高关税以限制进口”等一系列政策,限制跨国药企的同时促进了本土药企的快速发展。尤其是印度的强仿政策,直接推动了其仿制药产业的腾飞。随着仿制药企业数量激增,印度国内市场内卷日益严重。加之政府对药价严格限制,使得印度 20 世纪 80 年代成为全球药价最低的国家之一。为了生存与发展,一些先知先觉的印度企业积极谋划出海。恰逢此时,美国于 1984 年出台 Hatch-Waxman 法案,开启了美国仿制药发展的黄金时代。正是在 1984 年,印度CIPLA(西普拉)公司开始进军美国市场。之后越来越多的印度药企出海美国,他们赶上了美国仿制药市场大发展的政策红利。

中国医药行业改革开放后迎来快速发展,初期“市场换技术”的策略使得外资药企发展迅猛。2000 年以后,随着经济快速增长和医疗卫生支出规模逐步提升,中国仿制药产业迎来低水平重复的快速野蛮生长。多年来“以药养医”的氛围推动药品价格虚高,促使行业形成了“营销为王”的导向,国内仿制药质量水平参差不齐,但任何一家企业都能靠着灵活的销售手段,在国内市场掘到一桶金。那时中国企业并没有“走出去” 的生存压力。2015 年,业内著名的“722”事件可以作为仿制药行业发展的转折点,随着原国家食品药品监督管理总局出台了一系列政策,鼓励新药研发并加强了监管法规和欧美法规的对接,为中国药企拓展美国市场创造了更多可能。
印度药企当时面对的本国市场“僧多粥少”,出海有天然内在的需求。他们在 80 年代做出正确的行动,向美国市场进军,并且印度公司注重资源整合,抱团出海比比皆是,由此开启了印度仿制药的光辉岁月。中国药企长期依托国内市场红利,虽然进入美国市场较晚,但“道虽远,行则将至”,机会都是在一步一步的市场实践中去发现,去抓住。
三、产品走出去的对比
印度药企熟悉美国的监管法规、市场规则,尤其是他们在制作文件与文件管理方面非常出色,某种程度甚至超过了美国当地药企,因此其在美国仿制药的报批数量相比我们遥遥领 先。2010-2019 年十年间,印度药企占美国FDA 全部批准ANDA(仿制药注册申请)数超过 35%。仅印度太阳制药(Sun Pharma)一家,其获批 ANDA 的总量就已超过 400 个。印度药企已在美国形成了丰富的产品管线,仿制药在美国市场的销售已经成为印度药企收入的主要来源。
中国企业则起步晚了很多。直到 2007 年,华海药业的奈韦拉平成为首个通过 FDA 认证的中国制剂品种,中国企业才正式开启制剂拓展美国市场之路。2006~2010 的五年间,中国企业仅注册成功 ANDA 6 件;2010-2014 年,中国制剂年均获批 ANDA 数量也仅有 20 件左右。自 2015 年开始,中国制剂在美国获批ANDA 数量呈快速增长。2020 年中国制药军团收获创纪录的 84 个 ANDA 正式批文,也使得中国药企在美国 ANDA 获批数量连续三年占比总量达到 10%,但从获批的剂型来看较为单一,主要以口服制剂和注射剂为主。国内目前获批 ANDA 数量最多的是华海药业,截至 2022 年 4 月 6 日,累计获得 74 个ANDA 文号。
目前FDA 大大提高了仿制药的申报费用和年费。同时随着美国仿制药竞争加剧,价格下降,印度企业在美申报仿制药也在向少而精的方向转型。我国企业也要考虑学会如何用最低的成本增加在美国获批的品种。除了自己申报,也可以考虑利用美国现有的公司进行销售和持证,迅速进入美国市场并规避风险。毕竟持有ANDA 只是手段,销售收入分成才是最终目的。
四、以首仿药为代表的技术差距
随着美国普通仿制药市场成为一片红海,不少企业将目光投向了首仿药。FDA 一般会对首仿药进行优先审评。其定价可达原研的 70%左右,如专利挑战成功的首仿药还将拥有 180 天的市场独占期。2001 年,印度 Dr. Reddy’s(瑞迪博士)开发的40mg剂量的百忧解片剂,成为印度企业在美收获的第一个首仿药。凭借着过人的仿制药经验和对美国法规的熟悉,印度军团 不断在美国挑战新药专利,并争抢首仿,而且屡屡成功。以 Dr. Reddy’s 为例,截至 2018 年 3 月底,其处于审评中的 107 个ANDA,有 63 个进行了专利挑战,30 个为首家提交。
我国企业直到 2014 年,第一个美国首仿药普拉格雷才由东阳光药拿下。2017 年,华海药业的帕罗西汀胶囊成为国内第一个在美国 PIV 专利挑战成功的仿制药。以 2019 年为例,共有46 家企业在美分享了 95 项首仿药批准。印度公司共取得了超过 30 项首仿,占据三分之一左右。而中国企业仅宣泰医药一家取得泊沙康唑肠溶片的首仿。
“天下武功,唯快不破”。争取到了首仿才可能在美国市场获得丰厚回报。随着中国不断推进仿制药一致性评价, 中国企业按照 ICH 统一技术标准和全球评价体系研发仿制药的实力在不断提高和增强。未来高壁垒的首仿药也将会是中国制药企业在美国市场发展的方向。
五、国际并购与资本运作的差距
印度仿制药企能发展成国际巨头,与积极的并购密不可分。印度药企通过不断并购重组的方式,增加自身 ANDA 的数量,快速放大企业仿制药的规模,形成丰富的产品管线,逐渐建立了较强的市场壁垒。以印度太阳制药(Sun Pharma)为例, 自 1996 年首次收购跨国制药公司 Knoll Pharma 的原料生产基地开始,包括 2015 年收购 Ranbaxy,至今太阳制药已收购了 16家公司,其中涉及美国市场的有 5 项并购,使其成为印度在美国最大的仿制药企业。
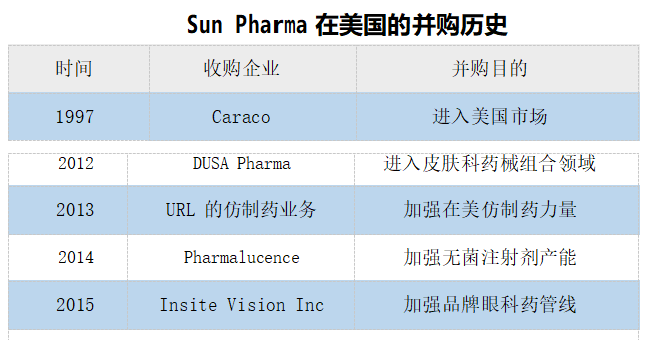
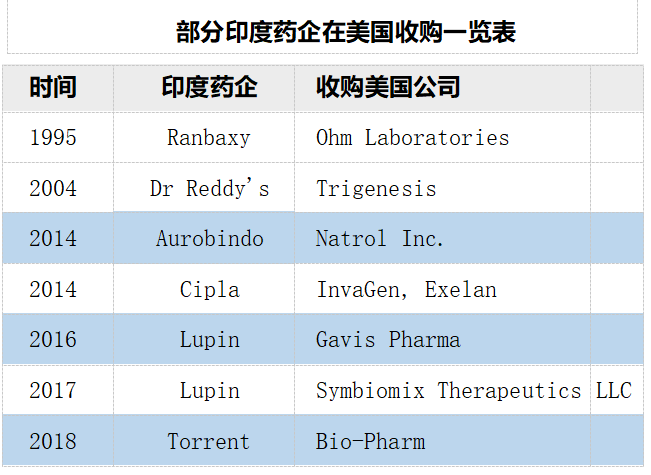
我国仿制药企业在海外并购相对保守。过去很多年,中国药企在海外的兼并收购凤毛麟角。一方面可能是与中印在并购的理念有较大差异,正如一位业内人士曾经说的:“印度企业认为国际并购是去获得,而中国药企却害怕国际并购会造成失去。”另外一方面,并购可能也和产业发展阶段息息相关,也需要一个慢慢积累的过程。自 2016 年中国药企开始有规模地实施海外并购。2016 年,华海在美国收购夏洛特工厂。同年人福医药以 5.29 亿美元收购 Epic Pharma, 依靠此项并购斩获多项ANDA 批件。2017 年复星医药耗资 10.91 亿美元成功并购印度制药企业 Gland Pharma。据悉截至 2020 年 Gland Pharma 与其合作伙伴在美国拥有ANDA 数量超过 260 份。
国际并购是企业国际化发展的加速器,跨国巨头做大做强无不依靠并购这把利器,这也是印度药企在美国市场拉开与中国同行差距的一个重要因素。“国际并购”未来对中国药企来说仍然任重而道远。
六、本土化产业链生态的差距
仿制药最终要在美国市场上市并盈利,涉及研发能力、国际注册、认证能力、市场准入以及营销体系等多个方面。印度公司熟悉美国 FDA 规则,研发速度快,申报能力强,印度国内满足 FDA 要求的临床机构比比皆是,且人工成本以及病床费用都比中国低很多。印度企业在美国市场经营多年,对美国仿制药销售规则了解充分,一些主流分销商也常见印度裔管理人员,印度企业在美国已实现研发、生产和销售多方面完备的产业生态体系,这为印度公司产品从开发到商业化铺平了道路。
以 Dr. Reddy's 为例,其在美扎根多年,在美国本土形成了完整的产业链,也有相对完善的销售体系,其产品在美国获批后 2 个月内就能将产品投放市场。
中国制药企业在经过持续努力获得 ANDA 后,到实现商业利润还有很长的路要走。印度裔在美国有很多医生和高级管理人员,他们成立了许多小销售公司,而且他们很善于建立印度裔关系网,在美国的销售如鱼得水。但是华裔,目前还很少有这样的销售网络和人脉。中国企业获批产品如何选择销售模式, 市场上面临的各种法规问题,对于尚未在美国市场形成体系的中国药企来说,难免困难重重,最终仿制药出口美国市场能形成销量并获得利润可能只是一厢情愿,成为一件“看起来很美”的事情。
国际化不是一朝一夕之功。印度军团进军美国市场多年, 不断的投入积累,也不乏经历挫折反复,才熬到了今天的辉煌。“历史是最好的老师”,印度药企在美国市场的发展之路,也将带给胸怀星辰大海的中国药企更多启示。
诚挚感谢汤丽娟教授、孟晓峰博士为本文提出的宝贵修改意见。
参考文献及数据:
1、中国医药保健品进出口商会、科睿唯安 《2020 中国医药产业国际化蓝皮书》
2、药融云数据库
3、张熊:为何非洲能成为印度第二大出口市场?对集采下的中国药企有哪些启示?E 药经理人
4、魏利军等,《跨国药企成功启示录》
5、澜亭资本,《印度仿制药企业崛起的经验与教训》
6、漫游药化,珍藏:中国制药的天敌!
7、2020-2021 Annual Report of Pharmexcil
8、印度各大药企官网
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论