地塞米松磷酸钠注射液为糖皮质激素药物,临床应用有特色。它具有影响糖代谢,抗炎,抗过敏,抗毒等多种作用。其抗炎和控制皮肤过敏的作用比泼尼松强,而对水、钠潴留和促进钾排泄作用较轻微。不良反应少,局部刺激较弱,水肿、高血压、肌无力等不良反应较小。在血液科、消化内科、皮肤科、呼吸内科、风湿免疫科均有使用。基于此,尽管上市多年,其销售额一直非常稳定。
尽管我国从2017年即陆续开展注射剂一致性评价工作,但地塞米松磷酸钠注射液的参比制剂却十分难产。直到2020年,国家局才陆续发布了其两个规格的参比制剂。

这么一个热门品种,参比制剂却公布得如此迟缓,说明参比制剂本身就有一定的争议。特别是国内销量的大头,1ml:5mg规格的参比制剂,贮藏条件居然要求2~8℃冷藏,给本来附加值就不高的品种带来了沉重的成本负担。要知道,国内这个品种一直以来都是室温保存的。那么,英国上市的参比制剂又为什么这么要求呢?美国上市的产品和英国又有什么区别呢?我们从这个产品的性质道来。
地塞米松磷酸钠,为地塞米松的钠盐。由于地塞米松不溶于水,因此将其制成溶解度好的钠盐,进而做出注射剂。地塞米松磷酸钠的水溶液易水解,其水解产生的游离地塞米松达到一定浓度,即会从水中析出,显现出小白点。在高效液相色谱仪都没有普及的早年间,困扰国内地塞米松磷酸钠注射液生产的,就是制剂小白点的产生以及含量的持续下降。当时的技术人员发现处方中加入亚硫酸盐,较大量的丙二醇,并且将pH值调到8以上,可以在一定程度上缓解其质量问题。这也成了早年间该品种的主流处方。

图1.地塞米松磷酸钠
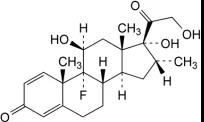
图2.地塞米松
2010年,中国药典在地塞米松磷酸钠注射液标准中增加了有关物质项。一时间市场上哀鸿遍野,各地抽检发现不合格品。不合格的项目主要有两个,一个是有关物质项下的杂质Ⅰ,另一个就是游离地塞米松。
杂质Ⅰ是处方中的亚硫酸盐与API结合产生的物质。技术人员发现,即使将处方中的焦亚硫酸钠或亚硫酸氢钠的用量降到很低,杂质Ⅰ仍然不受控制地增长,在很短时间内即超过药典限度。因此,大家逐渐弃亚硫酸盐不用。

图3.杂质Ⅰ
中国药典将游离地塞米松的限度规定到了不超过0.5%,这也同样难倒了不少人。后来,有的技术人员发现使用一定量的丙二醇降低溶剂介电常数,并且配合加入一定量的磷酸盐,可以有效地抑制水解。这也逐渐成为了后来市场上产品处方的主流。有的研究比较精细的企业,其产品的稳定性甚至远远凌驾于现如今公布的两个参比制剂。那么,参比制剂是怎么做的呢?
两个参比制剂的处方是这样的:
美国fresenius-kabi处方
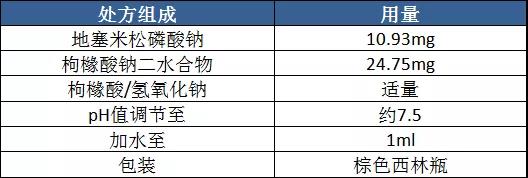
英国Aspen处方

我们发现,两个参比制剂的处方截然不同,显示他们的设计思路也截然不同。其实,一个注射剂产品的设计,都要满足临床的适用性和药学稳定性两方面的要求。在这一点上,两个参比制剂是一样的。只是,他们走的方向不同。现用一张表格阐释两个参比制剂的设计思路。
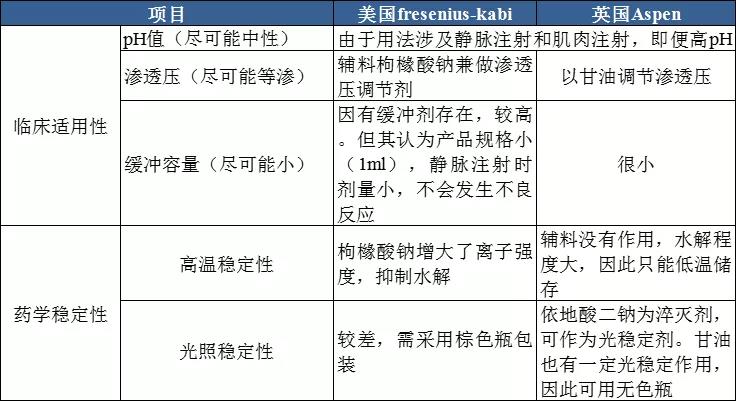
从上表可以看出,两家的产品都在临床的适用性和药学稳定性两方面做了权衡,处方设计不乏巧妙之处。比如美国参比的处方,其枸橼酸钠兼具pH值调节剂、渗透压调节剂、抑制水解的稳定剂三种作用,可谓一举三得。但他们的处方设计不可避免地在一定程度上牺牲了药学稳定性。为了弥补其缺失,分别采用了低温储存和有色瓶包装的方案。
那么对地塞米松磷酸钠注射液这个品种,假如我们只考虑临床的适用性或只考虑药学稳定性,那么设计出来的处方会是什么样的呢?可能会是这个样子:
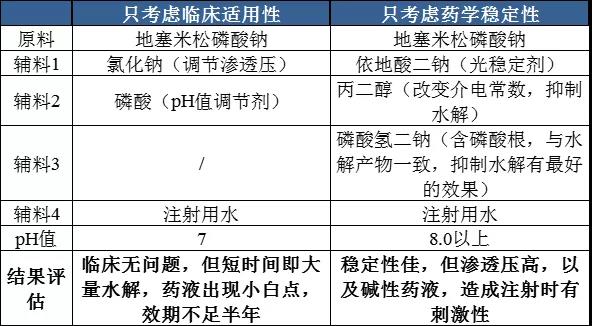
显然这两种方案都不能达到理想效果。药品处方的设计是个试验科学,要在某种程度上达到平衡。
但我们回过头来看看两个参比制剂的处方,真的设计得完美无缺了吗?特别是英国Aspen的参比,选择了冷藏运输保存的方案。对于这样一个临床广泛使用的药品,极大地增加了社会成本。理解了产品的特性,理解了处方设计的原理,或许我们可以在临床适用性、药学稳定性及成本三方面达成比参比制剂更好的平衡。希望有企业能站出来挑战本品的改良型新药,也希望监管部门能进一步完善审评体制,以促进我国药品的质量提升。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论