按照中国及其他ICH成员国相关法规指南,口服固体制剂稳定性质量标准研究项中仅规定了溶出度或者释放度研究项,并没有要求溶出曲线或释放曲线。
NMPA于2016年发布的《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)(2016年第120号)》文件中,有一段针对理化性质不稳定产品需要增加参比制剂稳定性溶出曲线考察。具体为“对有文献报道或者研究资料表明有光照、高湿、高温、氧化等条件下不稳定的品种,建议考察参比制剂溶出曲线稳定性,为实验室复核结果的重复性提供支持。……如变化较大,应根据具体情况调整试验方法,并将相应的试验方法和注意事项与复核单位沟通,保证复核结果的一致。申报资料要求提交至少3个月加速试验和3个月长期试验的溶出曲线数据以及结论,以表格形式整理。建议申报单位在长期试验条件下同时将参比制剂以及仿制制剂留样保存,直至药检机构复核试验结束或至有效期止。”从行文意图可知其目的主要是为了方便药检机构的方法复核,保障复核检验过程参比溶出曲线少出偏差,并没有要求对自研也进行稳定性溶出曲线检测。但实际执行中,行业内大部分已经在稳定性研究中自觉不自觉的增加了自研的溶出曲线检测。
那么需要在稳定性中增加溶出曲线检测吗?
首先从监管角度看。溶出度实验多为单种溶出介质、单点测定,方法有一定的局限性,对药物内在质量改变引起变化的反应灵敏程度相对较弱。而溶出曲线测定的是多个点拟合成的曲线,对药物溶出行为趋势的表达,对药物生产过程中原辅料、处方配比、工艺参数变化,以及药物储存过程中受环境变化带来的内在质量变化,比如硬度变化、原料晶型的变化、辅料间相互作用等带来的的反应都比溶出度更直观、更灵敏、更能真实表达产品的内在质量。图1是一个仿制药溶出案例,从中可看出,只看溶出度结果,自研产品是合格的,但此时溶出曲线同参比制剂已经不匹配。所以从监管的角度来说,稳定性中增加自研溶出曲线的研究有其合理性。
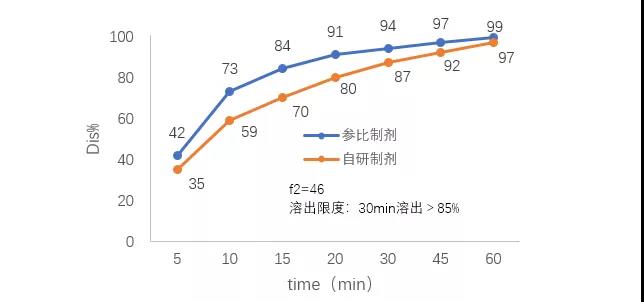
图1.某仿制药溶出曲线
从药品研发角度看。实事求是的说,生物等效性实验所用自研样品大多为新生产的样品,没有经过加速条件考验或者采用近效期的样品。所以生物等效性实验通过只能说明新生产的样品体内吸收同参比是一致的,不能代表效期内都能同参比一致。稳定性中因为药物辅料的相互作用、环境中温湿度的作用、原料药不同晶型的存在、包装材料的不同等影响因素,确实有可能带来溶出曲线的变化,这种变化也确实有可能带来体内吸收的改变。所以稳定性中增加溶出曲线的考察有其科学性。
但稳定性考察中有不同的放置条件、不同检测周期,如何考察,考察哪些?“科学严谨,事半功倍”的是我们要遵循的原则。如果每个产品、每种放置条件、每个时间点都检测溶出曲线,再加上参比制剂,那检测工作量无疑是巨大的。在仿制药集采已成为常态化的当下,节约成本是我们做研发始终要考虑的。需要指出的是稳定性溶出曲线检测是考察项,或者说观察项,不是必检项,因此有一定灵活操作的空间。结合工作中实际,总结了以下几点,供大家参考交流。
- 首先对自研制剂进行充分的风险评估
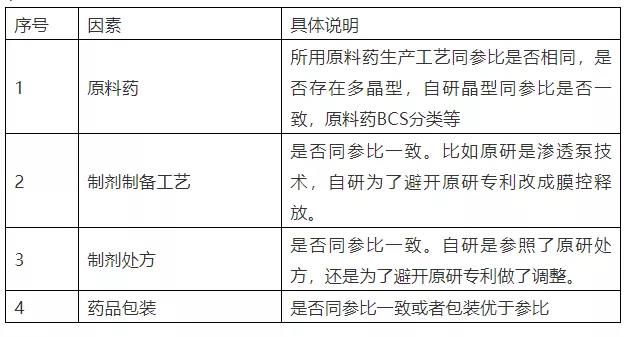
建议可以从以下维度考虑(见下表1),具体风险大小,需要研发人员根据对产品的了解、经验的积累来设置评估等级,不能一概而论。
表1.
二、基于风险高低设计自研产品稳定性溶出曲线考察策略
Ø 低风险产品
对于评估完认为低风险的,可以不进行稳定性溶出曲线考察,但最好在申报资料里对风险评估过程、风险评估结果进行说明。
Ø 中风险产品
对于评估后认为中风险的,可以增加适当的考察。比如选择一种最具有区分力的溶出条件,确定一批自研产品,在加速3月、6月进行考察。
Ø 高风险产品
对于评估后认为高风险的,就需要谨慎对待,不仅在稳定性中要做考察,在处方工艺开发过程中就需要做适当的研究。同时稳定性考察中要同步放置参比制剂。
三、案例分享
案例1:某一致性评价品种
- 风险评估
表2.

评估结论:综合评估认为该产品在稳定性放置条件下溶出曲线变化风险较低,稳定性条件中不再进行溶出曲线考察。
案例2:某避专利开发仿制药产品
- 风险评估
表3.
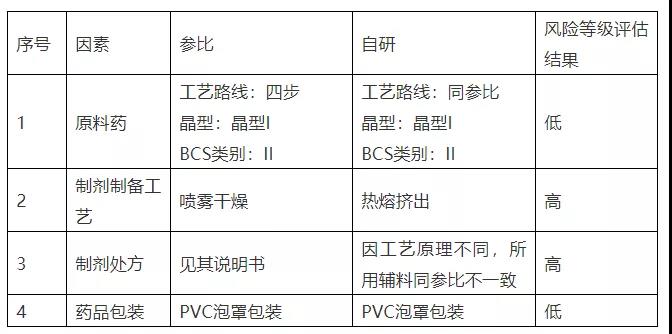
- 稳定性溶出曲线研究策略评估结论:综合评估认为,自研采用不同增溶方式,所用工艺、处方均不同于参比,稳定性条件下溶出曲线改变风险较高。
溶出条件:选择预BE试验确定的具有体内外相关性的溶出条件。
处方开发阶段评估:考察了最终处方自研在加速3个月内溶出曲线较稳定。
自研考察周期:确定一批自研考察加速3/6月和长期12/24月。
参比考察周期:同自研(自研出现变化后启动参比考察)。
- 稳定性溶出曲线考察结果
考察结果见图2. 经评估,该产品溶出曲线在稳定性加速和长期条件下是稳定的。
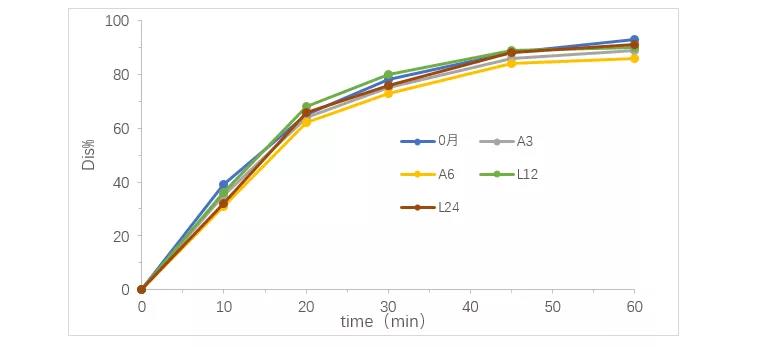
图2.稳定性溶出曲线考察结果
结语:溶出曲线作为药品体外评价的核心内容,对保证药品体内疗效的一致性起着关键作用。仿制药同参比质量的一致性不仅仅指新生产出来的一致或者某一阶段一致,而应该在整个生命周期内都应该同参比一致。如何切实保障这种一致,需要广大制药同行一起思考。
参考文献:
1.《化学药品仿制药口服固体制剂质量和疗效一致性评价申报资料要求(试行)(2016年第120号)》
2.《普通口服固体制剂溶出度试验技术指导原则(2015年第3号)》
3. 刘倩,张广超,牛剑钊,等. 美、日溶出曲线数据库对比研究及我国溶出曲线数据库建设进展[J].中国药事,2021,35(4):422-427







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论