3D打印技术是一项新型的打印技术,目前已涉及生物、制药等多个领域。在过去的几十年中,3D打印药物一直是学术界和业界的研究主题。目前,美国食品药品监督管理局(FDA)批准了唯一一个3D打印药物--Spritam(左乙拉西坦)。Spritam为口服治疗癫痫发作的药物,由ApreciaPharmaceuticals公司研发,按照505(B)(2)的申报途径申报NDA,2015年获得FDA批准上市,有250mg、500mg、750mg、1000mg四个规格。Spritam实现了以患者为中心的新治疗功能,仅需少量液体或唾液即可迅速崩解,在口腔中崩解时间约为1-15s。
Spritam的成功完全依赖于ZipDose技术平台,不仅扩大了产品管线和市场份额,还获得了持续的排他性,并为多领域的药物开发提供了新契机。
一、3D打印药物定义与主要过程
药品采用计算机辅助设计(CAD)进行3D(或2D)设计,将设计转换为机器可读模式(.stl文件格式),然后计算机程序将表面切成几个不同的可打印层,并将逐层指令传输到打印机来生产药物。3D打印药物研发、设计与生产主要涉及5个关键阶段,具体如下:
Spritam生产设备:液体-固体3D打印机
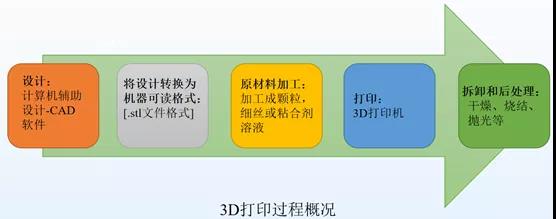
ApreciaPharmaceuticals在开发3D打印设备时,进行了诸多改进。设计原型机时要考虑工作空间、重复单元、生产效率、3D打印供料系统、干燥系统、传递系统等。液体-固体3D打印机工作简图简图1。
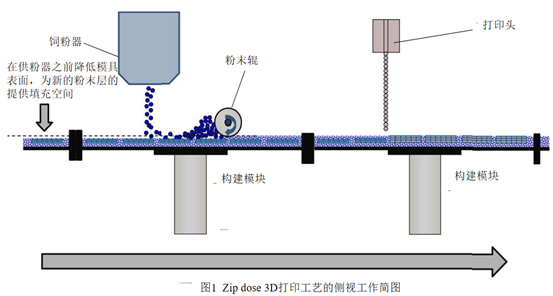
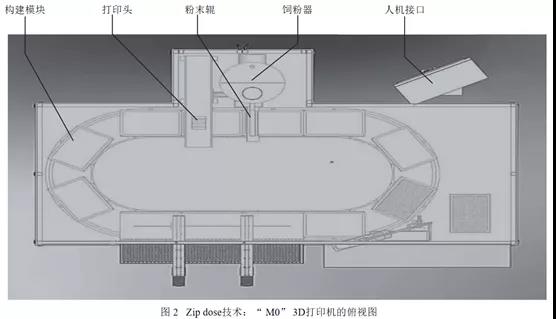
液体-固体3D打印机的供粉系统和供液系统的空间区域是分开的,分别处于半固定的位置。在最初的位置,构建模块下沉,为粉末提供填充空间,随着构建模块向右移动,供粉器将粉末填充至构建模块上,随后粉末辊将粉末铺平。当构建模块移动到打印头下方时,会在预设程序的命令下在相应的分层中喷出相应的液体图案,构建出相应的层次结构。每个构建模块在液体-固体3D打印机的循环系统中循环,供粉系统和供液系统不断执行电脑程序“下达”的命令,按照层积方式堆叠、交错,直至完成片剂的生产。液体-固体3D打印机供液系统有多个喷头组成,供粉系统所提供的的粉末应能够与构建模块的数量相匹配(第一代液体-固体3D打印机-M系列的M0有12个构建模块,图2),防止粉末浪费并提高生产效率。构建模块按照逆时针运动,12个构建模块在半圆形部分按照特定的角度分离,在直线部分紧密拼接。该打印机可用于处方开发、注册/验证批生产、商业批生产,符合cGMP要求。药物打印完毕后,在图2下方线性区域卸载构建模块,每次卸载3个,卸载后进入干燥程序。第二代液体-固体3D打印机(M1)是在M0的基础上进行了改良,自动化程度更高,产量是M0的2倍。
二、ZipDose技术介绍
ZipDose技术与制剂相关技术并无相关性,非生产过程、工艺或机器,而是针对于处方系列本身的技术。
早期美国进行的一项关于吞咽片剂和胶囊的难易程度的调查,该调查发现美国约有50%的成年人(n=1002)确认自己吞咽片剂、胶囊困难。以此为背景,ApreciaPharmaceuticals开发了ZipDose技术。ZipDose技术不仅解决了患者吞咽困难的
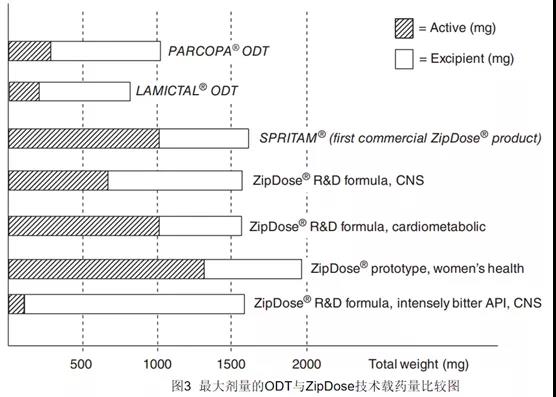
问题,还解决了普通口服固体制剂载药量低的的技术壁垒。不同技术制备的ODT(口崩片)优缺点见表1。与冻干、软压片技术制备的ODT相比,ZipDose技术制备的Spritam口崩片的最大载药量为1000mg(Spritam共有250mg、500mg、750mg、1000mg四个规格),载药剂量远远高于前两种技术。而这1000mg的载药量并不是ZipDose技术的最大剂量,ZipDose技术的原型药物(模型药物)最大载药量高达1300mg(见图3),总体来看ZipDose技术的载药量占有很大的优势,但不能否认ZipDose技术可用于小规格的制剂。高剂量的片剂是将API与辅料混合,在生产时喷射粘合剂溶液或水。低剂量的片剂是将API溶解到液体中后喷射到辅料粉床即可。
ZipDose技术平台处方具有广泛的适用性,适用于大分子和小分子药物,其化合物最好属于BCSI、II和III类药物。ZipDose技术可用于150多种药物,平台技术的兼容性也证明了该技术的先进性。不仅如此,ZipDose技术还可用于多种活性成分的复方,亦可与缓控释技术联用;所选用的辅料范围较广,灵活性较高,对快速崩解制剂的开发起到积极的促进作用。同时,ZipDose技术还具有良好的掩味作用,对掩味困难的原料药同样有效。与压缩型制剂相比,ZipDose制剂的孔隙率更高,能够保证唾液快速进入片剂内部,片剂颗粒之间的连接被破坏,片剂完整性迅速丧失。

ZipDose这种液体和固体的组合,需要深入了解目标化合物的质量属性,选择适当的辅料和打印参数。不需要特殊的、新颖的辅料,现有的辅料能够满足技术需求,Spritam所用的辅料也能证明这一点(Spritam处方所用辅料:胶态二氧化硅、甘露醇、微晶纤维素、聚山梨酯20、聚维酮、三氯蔗糖、丁基化羟基茴香醚BHA、薄荷香精)。所选用的辅料应在生产过程中能够润湿,兼具粘合作用,能够保证制剂给药后在口腔中润湿和崩解。辅料选择不合适,会影响片剂内部孔隙的润湿速度,从而降低片剂的崩解速率。ZipDose能够保证片剂具有辅料的粉体性质,也需要更高的结合性。由于API本身性质,可能会有不良的味道,因此处方中还涉及采用甜味剂、香料掩味,除此之外,还可采用环糊精包合物、包衣、离子交换树脂等技术掩味。这也是ZipDose技术追求的目标之一。
三、临床研究
Spritam并非真正意义上完整独立的NDA,但需要提供安全性和有效性研究。ApreciaPharmaceuticals公司开发Spritam时,使用Keppra(左乙拉西坦)速释(IR)片作为参比制剂(RLD);对于Spritam的只进行了BE/BA临床研究将Spritam与参比制剂桥接起来,评估了不用水送服Spritam和Keppra(IR)的PK数据。
在健康男性、女性受试者体内进行了Spritam与Keppra(IR)的PK研究,Keppra(IR)作为参比制剂。主要研究包括:1.禁食和进食情况下口服1000mgSpritam与Keppra(IR)的关键PK研究,结果表明:餐前口服1000mgSpritam和Keppra(IR)具有相同的吸收速率和程度;高脂餐后延长了Spritam的吸收,Cmax降低了36%。2.为了研究确定稳态时Cmax的变化,使用非参数叠加模拟,采用三种不同的给药方案研究了稳态暴露量:餐前口服Spritam1000mg(bid,每天两次)、餐后口服Spritam1000mg(bid,每天两次)、餐前口服左乙拉西坦缓释片2000mg(qd,每天一次)。二者峰谷浓度相近。餐后服用Spritam的Cmax低于餐前服用Spritam和左乙拉西坦缓释片。服药后约13-24小时范围内,餐后服药的血药浓度高于缓释片,认为Tmax和Cmax的变化不会对临床产生重大影响。服药用水量与PK参数之间没有明显的相关性。

Spritam与KeppraIR片疗效相似,具有相同的吸收速率和程度,故为进行药效学研究。在PK研究时没有发现严重的AE(不良事件)且与参比制剂具有相同的吸收率和程度,参考KeppraIR速释片的安全性,二者的不良反应也相似,故认为Spritam是安全的。最终FDA批准了Spritam上市。
四、总结
本文介绍了一下3D打印技术中的的ZipDose处方技术设计平台以及临床考虑,该技术有望实现覆盖更多的药品。ApreciaPharmaceuticals为药品技术应用多样化奠定了基础。随着3D打印技术的发展,将来会有越来越多的技术涌入药品研发,同时,3D打印药物也将会促进个性化医疗以及精准医疗,并为患者提供更多的治疗选择。

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论