
在糖尿病药物研发中,发现对减轻体重有异常好的效果,糖尿病与肥胖的紧密联系可见一斑。
肥胖主要通过触发胰岛素抵抗,引发糖尿病及多种代谢疾病的风险。与正常体重相比,超重人群患糖尿病的几率要高出3倍以上,肥胖人群的风险则超过10倍。甚至在体重超标显现之前,营养过剩已经促使胰岛素抵抗加剧,导致各种隐形疾病。

然而,肥胖如何导致糖尿病的具体机制却远比人们想象的要复杂。传统观念认为,细胞胰岛素信号的受损是胰岛素抵抗及随后糖尿病发生的主要驱动因素。但随着研究的深入,这一观点或许过于简化了肥胖与糖尿病之间的复杂关系,并且细胞胰岛素信号受损并非总是伴随着胰岛素功能减退。
在肥胖个体中,即使胰岛素信号传导通路看似正常,个体仍可能表现出显著的胰岛素抵抗。这一现象提示我们,肥胖导致糖尿病的原因可能远比单纯的胰岛素信号受损更为复杂。
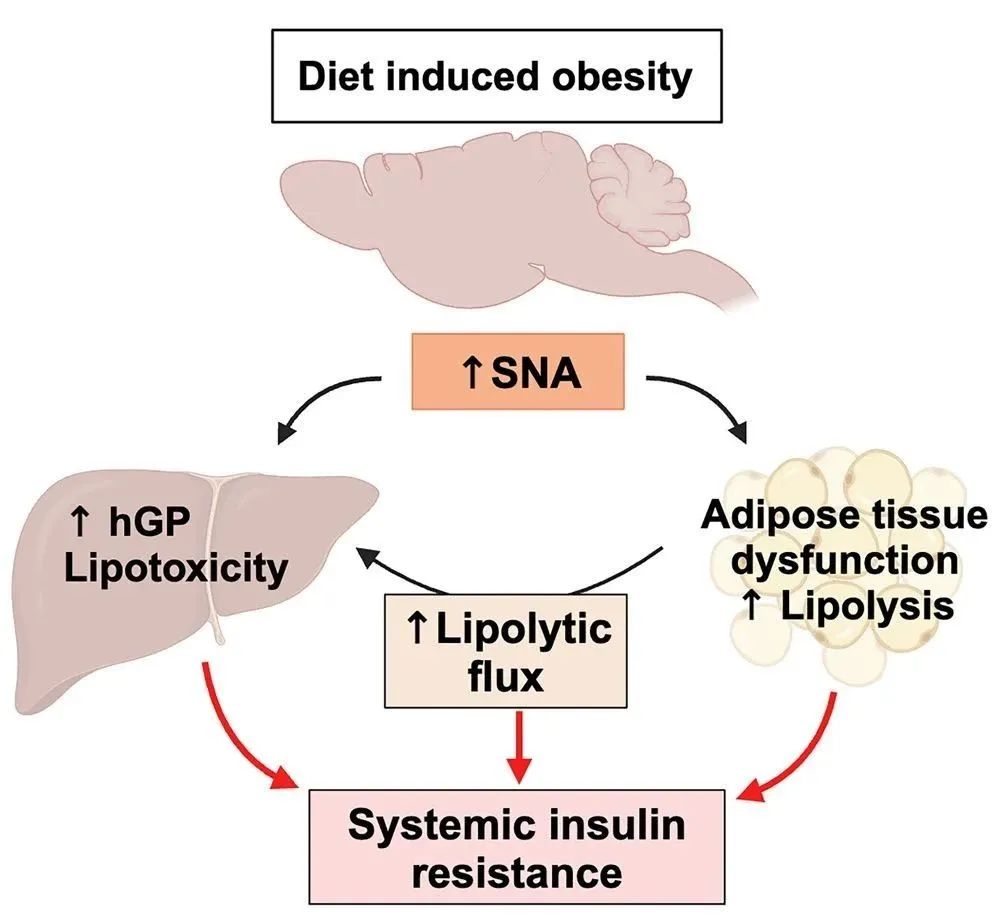
近年来,越来越多的研究开始关注交感神经系统(SNS)在肥胖及胰岛素抵抗中的作用。营养过剩会迅速增加血浆去甲肾上腺素(NE)水平,这是SNS过度激活的一个明确标志。SNS的激活不仅影响脂肪组织的代谢,还通过调节胰岛素敏感性和葡萄糖代谢来影响全身的能量平衡。
然而,关于SNS在肥胖中的角色,学界一直存在争议。一方面,有研究显示SNS活性(SNA)的增加与肥胖及胰岛素抵抗密切相关;另一方面,也有研究报道了SNA的减弱。这种分歧可能源于研究方法的差异、实验动物的选择以及肥胖模型的多样性。
美国罗格斯大学的生理学家Christoph Buettner教授长期关注糖尿病和胰岛素抵抗问题,他和同事们发现,在容易导致肥胖的高脂肪饮食条件下,交感神经系统会被过度激活,导致去甲肾上腺素(NE)等神经递质大量输送到肝脏等组织,触发脂肪大量分解,而这一过程与细胞胰岛素信号无关。
该发现发表在近期的《细胞-代谢》上,题为:Overnutrition causes insulin resistance and metabolic disorder through increased sympathetic nervous system activity 。

为了深入探讨SNS在肥胖导致糖尿病中的作用,该研究团队利用了各种先进的实验技术和模型。
其中,酪氨酸羟化酶(THΔper)模型的应用尤为引人注目。这一模型通过减少儿茶酚胺(CA)从SNS的释放,为研究SNS在胰岛素抵抗及代谢性疾病中的具体作用提供了有力的工具。
研究发现,减少CA的释放可以有效预防营养过剩引发的胰岛素抵抗、高胰高血糖素血症、脂肪组织功能异常及脂肪肝。这些发现表明,SNS的过度激活及其介导的脂肪组织脂肪分解可能是肥胖导致胰岛素抵抗及糖尿病的关键机制之一。
更重要的是,这一发现揭示了肥胖导致糖尿病的潜在机制可能并非单纯由胰岛素信号受损所引起。相反,SNS的过度激活及其下游效应可能在这一过程中发挥着更为关键的作用。这一新观点为我们理解肥胖与糖尿病之间的复杂关系提供了新的视角,也为开发针对肥胖及糖尿病的新型治疗策略提供了潜在的靶点。
研究示意图
综上,肥胖导致糖尿病的原因远比人们想象的要复杂。尽管胰岛素信号受损在糖尿病的发病过程中扮演着重要角色,但越来越多的证据表明,SNS的过度激活及其介导的脂肪组织代谢异常可能是肥胖诱发糖尿病的更为关键的因素。
因此,在未来的研究中,需要更加深入地探讨SNS在肥胖及胰岛素抵抗中的作用机制,以期为肥胖及糖尿病的防治提供更为有效的策略。
论文链接:
https://www.sciencedirect.com/science/article/abs/pii/S1550413124003760?via%3Dihub
免责声明




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论