 关注小药说药,一起成长!
关注小药说药,一起成长!在过去十年中,以免疫检查点抑制剂和细胞疗法为形式的癌症免疫治疗改善了许多患者的治疗和预后。尽管如此,大多数癌症仍然对目前批准的癌症免疫疗法具有耐药性。需要新的方法和合理的组合来克服这些阻力。
最新的研究表明,肿瘤微环境中含唾液酸聚糖的唾液酸与肿瘤浸润免疫细胞上唾液酸结合免疫球蛋白样凝集素(Siglec)受体之间的相互作用可能代表一个新的免疫检查点和癌症免疫治疗的潜在新靶点。
Siglecs是一类与含唾液酸的聚糖结合的受体家族。大多数Siglec受体是抑制性的,目前发现 15 种人源和 9 种鼠源的Siglec 分子。Siglec受体可进一步分为序列保守的受体和与CD33相关的快速进化受体。Siglec-1、Siglec-2(CD22)、Siglec-4和Siglec-15属于保守家族;Siglec-3(CD33)、Siglec-5、Siglec-6、Sigleg-7、Siglec8、Siglec-9、Sigle-c-11、Siglec-XII、Siglec-14和Siglec-16属于快速演化的CD33相关Siglecs受体。
根据细胞内信号结构域的不同,Siglec受体也可分为抑制型、激活型和非信号型。Siglec-11、Siglec-14和Siglec-15属于激活型Siglec受体,而Siglec-1和Siglec-4没有直接的免疫调节细胞内结构域。所有其他人类Siglec受体在本质上都是抑制性的。Siglec 家族属于一次穿膜的Ⅰ型膜蛋白, 在结构上具有非常典型和保守的结构特征, 其穿膜区由 2 ~17 个胞外 Ig 结构域组成,N 端由一个结合唾液酸的V-set Ig 结构域和一定数目的 C2-set Ig 结构域组成。
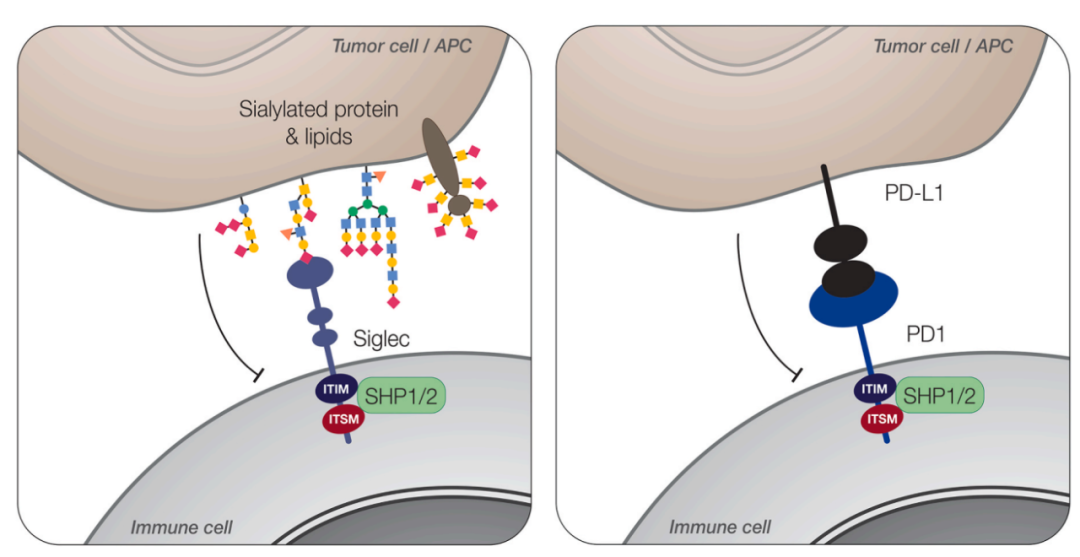
抑制性Siglec受体细胞内含有免疫受体酪氨酸抑制基序(ITIM)和免疫受体开关基序(ITSM)的结构域,可以通过SHP1和SHP2磷酸酶的参与调节细胞内信号。因此,抑制性Siglecs可以与PD-1/PD-L1类似的作用方式抑制免疫细胞激活。激活型Siglec受体具有带正电荷氨基酸的跨膜结构域,当CRD与唾液酸聚糖配体结合时,该跨膜结构区介导DAP12的招募,DAP12包含免疫受体酪氨酸基激活基序(ITAM),并可传递激活信号。
许多研究报告了癌症和肿瘤微环境中唾液酸聚糖的表达变化,肿瘤细胞通常是高唾液酸化的,产生免疫细胞上抑制性Siglec受体的配体。例如,由于唾液酸转移酶ST3GAL1和ST3GAL4的过表达,胰腺导管腺癌(PDAC)肿瘤细胞显示出唾液酸化增加。PDAC细胞的唾液酸化被髓系细胞上的Siglec-7和Siglec-9识别,并使单核细胞向促瘤巨噬细胞极化。同样,Siglec-9配体的上调已在人类结直肠癌、前列腺癌、乳腺癌和非小细胞肺癌中得到证实。
通过全基因组筛查,已确定唾液酸化CD43是Siglec-7的高度特异性配体,抑制NK细胞介导的K562白血病细胞杀伤。LGALS3BP已被证明是几种Siglecs(包括Siglec-9)的分泌型癌相关配体,可抑制中性粒细胞活化。CD24在许多癌症中过表达,并通过与Siglec-10在肿瘤相关巨噬细胞(TAM)上的相互作用,成为某些卵巢癌和乳腺癌中免疫逃避的主要机制。此外,可溶性CD52同样与T细胞上的Siglec-10结合,据报道在自身免疫性疾病中抑制T细胞。
Siglec受体广泛表达于免疫系统的不同细胞上。已证明,不同免疫细胞上的唾液酸聚糖配体和Siglec受体之间的功能相关相互作用有助于在癌症背景下建立免疫抑制微环境。
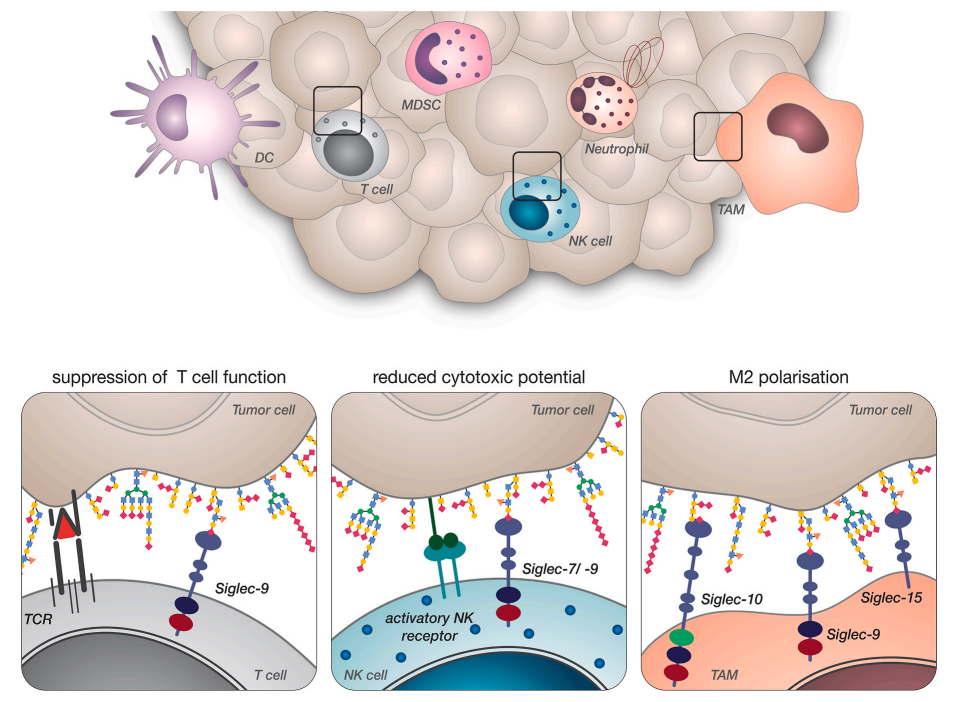
固有免疫细胞,特别是巨噬细胞,高表达几种不同的Siglec受体,包括Siglec-3、Siglec-5、Siglec-7、Siglec9、Siglec-10、Siglec/14和Siglec-15。最近证明,唾液酸聚糖对胰腺癌细胞的Siglec-7和Siglec-9结合可诱导促肿瘤巨噬细胞表型。。此外,已经表明,癌细胞上的唾液酸化CD24与TAM上的Siglec-10相互作用可以抑制吞噬作用。巨噬细胞上的Siglec-15也被证明可以抑制T细胞介导的抗肿瘤免疫。
树突状细胞是抗肿瘤免疫反应的重要介质,与免疫治疗的成功密切相关。最近的研究进一步表明Siglec受体在经典树突状细胞(cDC)上的作用。已证明DC上的小鼠Siglec-G可以调节抗原处理;此外,小鼠体内的Siglec-E被证明参与了抗原摄取和向CD4+T细胞的递呈。在小鼠模型系统中,抗原的唾液酸化可通过Siglec-E诱导耐受性调节性T细胞。人单核细胞衍生树突状细胞上的唾液酸聚糖通过Siglec-7和Siglec-9抑制免疫细胞激活。唾液酸聚糖还可诱导DC和CD8+T细胞之间的高亲和力相互作用。
NK细胞是重要的先天性淋巴细胞。几组研究表明,NK细胞上的Siglec-7和Siglec-9可与癌症相关唾液酸聚糖作用,参与抑制抗肿瘤免疫激活。将合成唾液酸聚糖插入肿瘤细胞的细胞膜能够剂量依赖性地抑制NK细胞介导的杀伤和脱颗粒。最近的工作进一步证明Siglec-7与多发性骨髓瘤细胞上的唾液酸化PSGL-1相互作用,能够抑制NK细胞介导的骨髓瘤细胞杀伤。此外,在肾癌细胞中,神经节苷脂Siglec-7配体的过表达抑制NK细胞活化;唾液酸化MUC16结合人Siglec-9并抑制卵巢癌中的NK细胞。
除了影响髓系细胞和其他先天免疫细胞外,唾液酸聚糖-Siglec相互作用也影响癌症的适应性免疫系统。研究发现,Siglec-9在癌症患者血液和肿瘤浸润性T细胞中上调,其在肿瘤特异性耗竭的PD-1+T细胞上表达。肿瘤细胞上Siglec-9配体的减少显著诱导T细胞介导的效应器功能和肿瘤细胞杀伤。在T细胞急性激活后,Siglec-5和Siglec-10也被发现上调,并可能影响抗肿瘤免疫。
总之,唾液酸聚糖与Siglec受体的相互作用已被证明通过诱导肿瘤相关巨噬细胞的促癌表型、抑制NK细胞和中性粒细胞活化、减少DC成熟和抗原提呈以及抑制T细胞反应,有助于免疫抑制肿瘤微环境。
近几年以来,作为肿瘤抗原的Siglec受体一直是治疗癌症的重要靶点。Siglec-2(CD22)在许多B细胞恶性肿瘤中表达,抗体偶联药物(ADCs)已成功用于靶向肿瘤细胞,如inotuzumab ozogamicin治疗复发性急性淋巴细胞白血病。靶向Siglec-2和CD19的CAR-T细胞也被开发用来治疗复发性弥漫性大细胞B细胞淋巴瘤或急性淋巴细胞白血病患者。此外,靶向Siglec-3的ADC也在开发和测试当中。
除了作为一种直接的肿瘤相关性抗原,Siglec受体及其唾液酸聚糖配体也可以作为靶向激活免疫细胞对抗肿瘤。Siglec受体可以被高亲和力抗体阻断,类似于PD-1/PD-L1和CTLA-4的免疫检查点抑制剂。阻断性抗体NC318以Siglec-15为靶点,目前正在进行一项对晚期非小细胞肺癌患者联合使用pembrolizumab的临床研究(NCT04699123)。Siglec-7和Siglec-9是提高NK细胞抗肿瘤活性的潜在靶点,一项使用Siglec-7和-9阻断性抗体的临床前研究证明了在小鼠模型中的抗肿瘤功效,阻断抑制性Siglec受体可支持免疫抑制微环境中TAM的复极,增加抗肿瘤巨噬细胞的吞噬作用。此外,肿瘤细胞上CD24与肿瘤相关巨噬细胞上Siglec-10之间的相互作用被认为是增强巨噬细胞吞噬作用的新治疗靶点。
另一种方法是使用针对特定糖类的阻断性抗体。最近的一项研究表明,抗神经节苷脂GD2的抗体可以通过抑制巨噬细胞上GD2与Siglec-7的结合来提高抗肿瘤免疫,从而通过进一步增加吞噬作用来增强CD47阻断的效果。此外,降低肿瘤细胞和肿瘤微环境中的唾液聚糖密度是一种替代策略。可以开发新的唾液酸生物合成抑制剂,以改善癌症免疫治疗。在小鼠模型中,使用2-脱氧-D-葡萄糖抑制肿瘤细胞的N-糖基化可增加CAR-T细胞介导的杀伤作用和疗效。使用酶降低肿瘤中唾液酸聚糖的密度也被证明可以增强抗肿瘤免疫治疗,与抗HER2抗体trastuzumab偶联的细菌唾液酸酶,目前正在首次人体临床试验。
癌症免疫治疗的改进需要开发新的方法。Siglec受体及其与唾液酸聚糖配体的相互作用是改善癌症免疫治疗的一个潜在的新型免疫检查点。在过去的几年里,已经进行了一些临床前和临床研究,支持了针对Siglec受体的药物开发。以唾液酸聚糖-Siglec轴为靶点的癌症免疫治疗显示出良好的潜力。
参考文献:
1.Siglec receptors as new immune checkpoints in cancer. Mol Aspects Med.2022 Aug 7;101112.
公众号内回复“肿瘤免疫”或扫描下方图片中的二维码免费下载《小药说药肿瘤免疫全集》的PDF格式电子书!

公众号已建立“小药说药专业交流群”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论