2023年诺贝尔生理学或医学奖授予Katalin Karikó和Drew Weissman,以表彰他们在核苷碱基修饰方面的发现,这些发现使得针对COVID-19的有效mRNA疫苗得以快速开发。高度可编程的mRNA疫苗,是保护我们免受COVID-19等快速进化病毒侵袭的强大工具。

mRNA疫苗的出现开创了疾病预防和治疗的新时代,为医疗领域带来了全新的解决方案。mRNA疫苗代表了一项突破性技术,能够迅速适应新出现的病原体,如颁奖词中提到的快速开发COVID-19疫苗。除了传染病之外,mRNA疫苗还有延伸到其他各个方面的澎湃潜力。在癌症领域,mRNA疫苗提供了激活免疫系统靶向肿瘤细胞的能力,将推动个性化癌症免疫治疗进入新的阶段。
此外,mRNA疫苗通过靶向特定疾病相关蛋白,为解决自身免疫性疾病、过敏性疾病和罕见遗传病带来新的可能性。它们还可以通过促进组织修复与再生来彻底改变再生医学领域。mRNA技术的多功能性和适应性为解决复杂疾病提供了强大的武器库,为更有效的跨学科协作、量身定制和可扩展的治疗方案带来了希望。
作为细胞分子生物学领域的强大工具,单细胞测序(Single cell sequencing )使研究人员能够在单细胞水平上对细胞异质性和基因表达谱获得前所未有的见解。近年来,单细胞测序在促进我们对mRNA疫苗机制的理解和发现改进方法方面发挥了关键作用。正如我们所知道的,为充分发挥mRNA疫苗的澎湃潜力,将其作为一种精确的武器来对抗感染因子或像癌细胞这样的异常细胞,就需要告诉mRNA疫苗它应该瞄准那些“坏”细胞的准确信息。
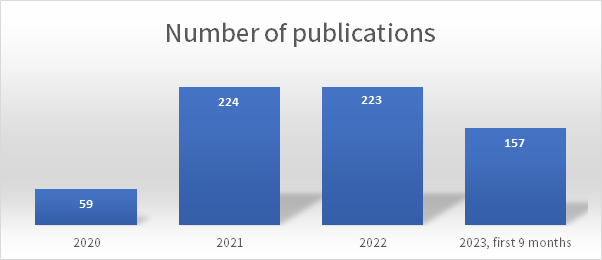
如Figure 1所示,2020年以来有数百篇科研论文将单细胞测序应用在mRNA疫苗研究中。接下来,小新将为大家分享几篇值得注意的该领域文章,一起体会单细胞测序在促进mRNA疫苗的开发和优化方面的力量。
感染或接种疫苗后,对病毒抗原的免疫反应需要持久产生抗体和T细胞,才能真正起到免疫作用。基于人群的监测通常侧重于抗体滴度(antibody titer),这需要刻画T细胞和B细胞反应的表征-----而这正是单细胞测序技术的用武之地。
单细胞技术解析感染-免疫机制
Kramer团队使用不同的单细胞分析方法来鉴定和表征抗原特异性细胞和抗体对mRNA疫苗BNT162b2的反应。发现抗原特异性记忆CD4+和CD8+ T细胞具有滤泡或外周辅助细胞的特征。此外,B细胞受体测序能够刻画B细胞从IgM到SARS-CoV-2-特异性IgA和IgG记忆B细胞和浆母细胞的轨迹[1]。
T细胞和B细胞在mRNA疫苗接种后的免疫反应也值得进一步研究。Zhang等利用多模态测序技术对mRNA疫苗BNT162b2免疫前后收集的循环人类白细胞进行了深入分析。研究者在初次接种疫苗后28日,检测到具有生物标志物抗原特异性CD8+ T细胞亚群[2]。在B细胞方面,Assis等利用单细胞多组学分析表明,在对SARS-CoV-2 感染者mRNA初次接种产生应答时,浆母细胞、活化记忆B细胞和静息记忆B细胞协调发育[3]。

扩展mRNA疫苗应用中的新格元单细胞产品力
mRNA疫苗的应用不限于COVID-19,也可以用于预防COVID-19以外的其他传染病。Xiong等利用新格元单细胞测序产品研究了一种基于mRNA的广谱候选疫苗,研究团队通过合理的抗原靶点选择,开发了一种多抗原联合的新型广谱流感mRNA疫苗,可在小鼠模型中诱导产生全面的具有交叉反应性体液和细胞免疫反应,并通过多种机制介导有效的广谱保护作用,为新一代通用流感疫苗的研发提供了新的思路[4]。
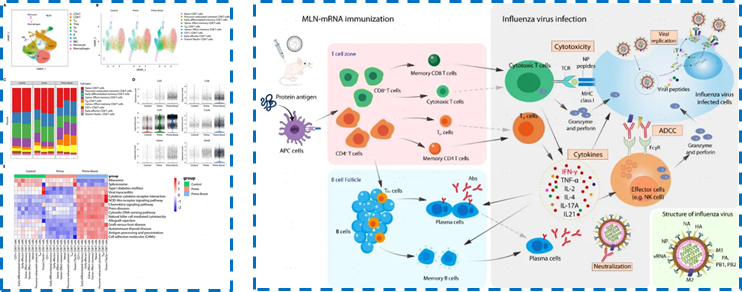
单细胞技术刻画肿瘤免疫微环境
mRNA疫苗的多功能和精准性也使其成为个性化肿瘤免疫治疗的有力工具。最近《自然》杂志发表了一种个性化mRNA疫苗策略——autogene cevumeran(BNT122)[5]。研究团队结合化疗(mFOLFIRINOX方案)和免疫检查点疗法(抗PD-L1单抗),为16名手术切除后的胰导管腺癌(Pancreatic ductal adenocarcinoma, PDAC)患者注射了一种个性化mRNA疫苗——autogene cevumeran,该疫苗表达了多达20种新抗原。使用T细胞测序,发现疫苗扩增的T细胞占所有血液T细胞的10%,其中包含新抗原特异性效应CD8+ T细胞。单细胞测序技术分析CD8+ T细胞的分子特征,研究团队在50%的患者中观察到明显的T细胞响应,表明mRNA疫苗可以引发增强的免疫反应。
兵家孙子曰:“知己知彼,百战不殆”。单细胞测序技术可以帮助我们刻画免疫微环境,更好地理解mRNA的功能机制,从而与开创性的mRNA疫苗技术一道赢得改善人类健康的所有战争。
# 引文
[1] Nat Commun 13, 3466 (2022). https://doi.org/10.1038/s41467-022-31142-5.
[2] Zhang, B., Upadhyay, R., Hao, Y. et al. Multimodal single-cell datasets characterize antigen-specific CD8+ T cells across SARS-CoV-2 vaccination and infection. Nat Immunol 24, 1725–1734 (2023). https://doi.org/10.1038/s41590-023-01608-9
[3] Lopes de Assis F, Hoehn KB, Zhang X, Kardava L. et al. Tracking B cell responses to the SARS-CoV-2 mRNA-1273 vaccine. Cell Rep. 2023 Jul 25;42(7):112780. doi: 10.1016/j.celrep.2023.112780. Epub 2023 Jul 12. PMID: 37440409; PMCID: PMC10529190.
[4] Xiong F, Zhang C, Shang B, Zheng M, Wang Q, Ding Y, Luo J, Li X. : An mRNA-based broad-spectrum vaccine candidate confers cross-protection against heterosubtypic influenza A viruses. Emerg Microbes Infect. 2023 Dec;12(2):2256422. doi: 10.1080/22221751.2023.2256422. Epub 2023 Sep 6. PMID: 37671994; PMCID: PMC10512870
[5] Rojas, L.A., Sethna, Z., Soares, K.C. et al. Personalized RNA neoantigen vaccines stimulate T cells in pancreatic cancer. Nature 618, 144–150 (2023). https://doi.org/10.1038/s41586-023-06063-y.
# 参考网页
https://new.qq.com/rain/a/20230921A04SVX00
https://www.thepaper.cn/newsDetail_forward_23040306
诺奖官网



































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论