
SRC,即肉瘤病毒蛋白Src,它是一种非受体酪氨酸激酶,属于Src家族蛋白酪氨酸激酶成员,由人体细胞自身的SRC基因编码。SRC在多种细胞类型中都有表达,尤其在淋巴细胞和成骨细胞中表达较高。SRC的作用机制主要通过其激酶活性参与调节细胞内的信号传导,它能够磷酸化多种蛋白质的酪氨酸残基,从而激活或抑制这些蛋白质的功能。SRC的活性受到多种因素的调控,包括磷酸化、去磷酸化、寡聚化和与膜的结合等。SRC在生物学上的意义非常广泛,它参与了细胞的多种生理过程,包括细胞增殖、分化、迁移、黏附和凋亡等。SRC通过激活下游的多种信号通路,如MAPK、PI3K/AKT、JAK/STAT等,对细胞的生存和功能发挥重要作用。此外,SRC的功能异常与多种疾病的发生发展有关,尤其是与肿瘤的发生、发展和转移密切相关。在肿瘤细胞中,SRC的过度活化可以促进肿瘤细胞的增殖和侵袭,使其成为肿瘤治疗中的一个潜在靶点。
在细胞信号传导中,Src蛋白在细胞信号传导中的作用不仅限于影响磷酸化微管蛋白(MAPK),它还参与了多个细胞过程。Src蛋白在细胞信号传导中对MAPKs的影响主要体现在它能够直接调控MAPK信号通路的上游激活蛋白Ras。活化的Ras可以与丝氨酸/苏氨酸蛋白激酶Raf-1的氨基端结合并使其激活,从而参与细胞的增殖和分化。此外,活化的MAPK通路也可磷酸化Src激酶的相应位点,导致转录因子激活,进而影响细胞周期和细胞转化过程。参与的细胞过程包括:
细胞黏附和侵袭:Src激酶在细胞与细胞(黏附连接)和细胞基质(黏着斑)连接的动态转换中起着关键作用,影响细胞的运动、存活和增殖。 细胞增殖和存活:Src激酶的激活能促进细胞周期蛋白的表达,加速细胞从G1期向S期过渡,引起细胞增殖。 激活其他信号通路:Src激酶能激活Janus激酶(JAK)-信号转导和转录激活因子(STAT)通路,引起细胞增殖。 调节离子通道:作为下游效应物,BK通道的开放或关闭直接受到Src激酶的调控。 参与肿瘤发生:Src激酶可直接调控MAPK信号通路的上游激活蛋白Ras,参与细胞的增殖和分化。 与其他信号通路的交互:Src激酶可直接激活FAK和其同系物Pyk2,调控细胞黏附和迁移。活化的Src激酶可影响Rac/Rho通路,调节细胞骨架、调节三磷酸肌醇和二酰甘油的生成途径、调节进入细胞的Ca2+以及激活不同亚型的蛋白激酶C。 调节PI3K/Akt信号通路:Src激酶参与调节PI3K/Akt信号通路以促进细胞的存活。 在B细胞功能中的作用:Src家族蛋白激酶在B细胞的发育、成熟、增殖和免疫耐受中起作用,影响自身免疫性疾病的发展。
此外Src蛋白在肿瘤发生和发展中也扮演着多重角色,它不仅能够通过激活MAPK/ERK等信号通路促进肿瘤细胞的增殖,还能通过调节细胞骨架来影响肿瘤细胞的侵袭和迁移。此外,Src蛋白参与VEGFR信号通路,从而促进肿瘤血管生成,为肿瘤提供营养和氧气。它还涉及调节肿瘤细胞的代谢过程,包括糖酵解和线粒体代谢,以支持肿瘤细胞的快速增长。Src蛋白还可能与肿瘤免疫逃逸有关,通过影响免疫检查点分子来帮助肿瘤细胞躲避免疫系统的攻击。鉴于其在肿瘤生物学中的中心作用,Src蛋白成为了抗肿瘤药物开发的重要靶点,并且其表达水平和活性可作为预测肿瘤进展和治疗反应的生物标志物。因此,SRC家族成员是药物开发的重要靶点,尤其是在抗癌药物研究领域。
本文除介绍SRC外还有与受其调控的PDGFR、VEGFR及DDR家族。PDGFR、VEGFR和DDR属于酪氨酸蛋白激酶家族。酪氨酸蛋白激酶(protein tyrosine kinase, PTK)是一类能催化ATP上γ-磷酸转移到蛋白酪氨酸残基上的激酶,共同特征是其羧基端具有典型的PTK结构域,该酶可催化自身或底物磷酸化,在细胞生长、增殖、分化中具有重要作用。迄今发现的酪氨酸蛋白激酶中多数是属于致癌RNA病毒的癌基因产物,也可由脊椎动物的原癌基因产生。

图1.酪氨酸激酶家族的受体和非受体分类。

图2. Src在免疫细胞中的作用。
血小板衍生生长因子受体(PDGF)属受体酪氨酸激酶跨膜糖蛋白二聚体分子,在正常的内皮细胞、平滑肌细胞和成纤维细胞以及神经细胞等多种细胞中均有分布,且在多种人肿瘤细胞呈高表达。PDGFR在细胞外结构域与配体PDGF结合被激活,引起细胞内PDGFR结构域的二聚化和随后的自身磷酸化,从而导致下游细胞内信号通路途径的激活和信号传导,该途径的异常活化在细胞迁移,分化或增殖中起重要作用。PDGF信号通路异常活化或突变与多种疾病的发生和发展相关,包括癌症、肺纤维化和动脉粥样硬化等。
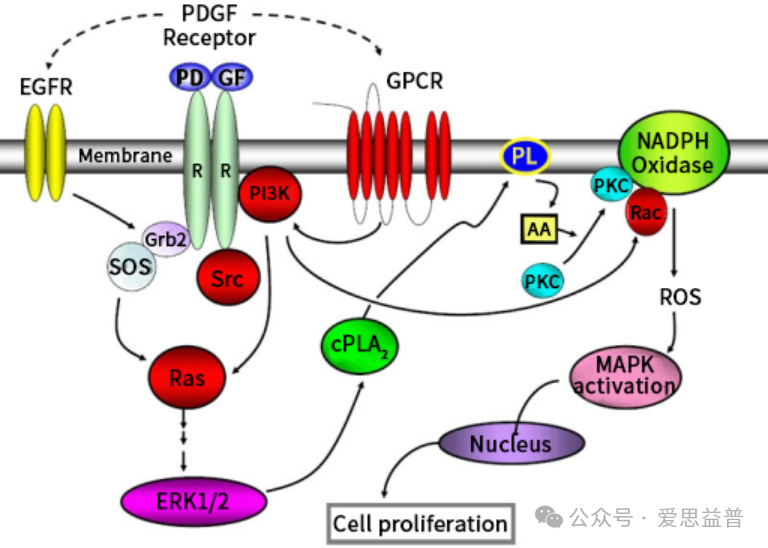
图3. 血小板衍生生长因子(PDGF)信号通路
血管内皮生长因子 (VEGF) 是一种强效的生长和血管生成细胞因子。其会刺激内皮细胞的增殖和存活,促进血管生成和血管通透性。VEGF 在血管化组织中表达,在正常和病理血管生成中起着重要作用。大量证据表明 VEGF 对肿瘤转移和眼内新生血管内综合征的诱导作用。VEGFR受体家族作为生长因子受体的成员,血管内皮生长因子受体(VEGF受体)细胞外由7个免疫球蛋白样组成的胞外区、一个跨膜区域和一个细胞内分裂酪氨酸激酶结构域组成。VEGFR1是造血干细胞募集以及单核细胞、巨噬细胞迁移所必需的,而VEGFR2和VEGFR3分别是血管内皮细胞和淋巴管上皮细胞功能所必需的。VEGFR-1和VEGFR-2主要表达于血管内皮细胞,而VEGFR-3主要表达于淋巴管内皮细胞。
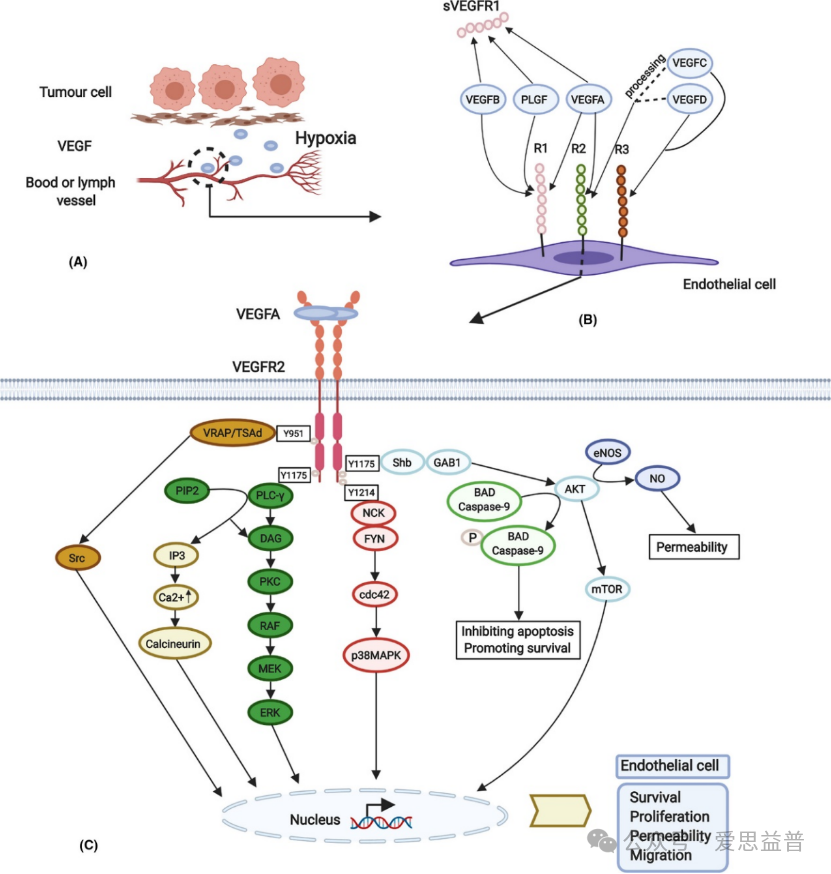
图4. VEGF-VEGFR信号通路的促进、组成和细胞内激活。
盘状结构域受体(discoidin domain receptor,DDR)是一种胶原激活的受体酪氨酸激酶,在调节细胞的形态发生、分化、增殖、黏附、迁移、侵袭和基质重塑等重要过程中发挥重要作用,主要在人体多种组织的表皮细胞中表达。DDR1 和 DDR2 的高表达或者突变与多种恶性肿瘤有关,而且 DDR过表达与肿瘤淋巴结转移显著相关。DDR1是阻止免疫细胞靠近肿瘤的关键蛋白;抑制 DDR1 的表达可以降低肿瘤微环境(TME)中的免疫抑制作用,有望成为肿瘤免疫治疗的新靶标。研究发现,在肿瘤发展过程中,DDR1 可以使细胞外基质(ECM)变为高度有序的状态,就像在肿瘤周围包裹上一层“铁丝网”,阻碍免疫细胞浸润及其杀伤肿瘤细胞的作用。在 TNBC 小鼠模型中敲除 DDR1,可以促进肿瘤内 T 细胞的浸润,并能抑制肿瘤的生长。因此,敲除 DDR1 基因或通过抑制 DDR1,有可能阻断肿瘤的抗免疫监控的能力,让免疫细胞成功进入肿瘤杀伤肿瘤细胞。

图5. DDRs信号通路
PDGFR家族
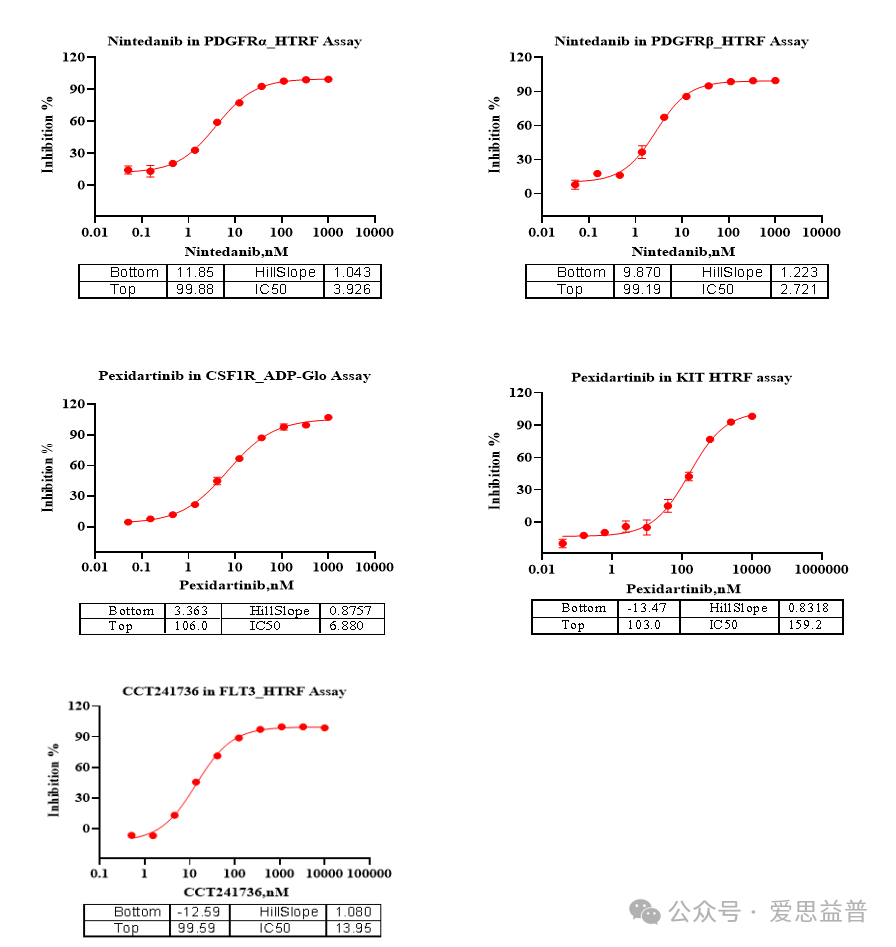
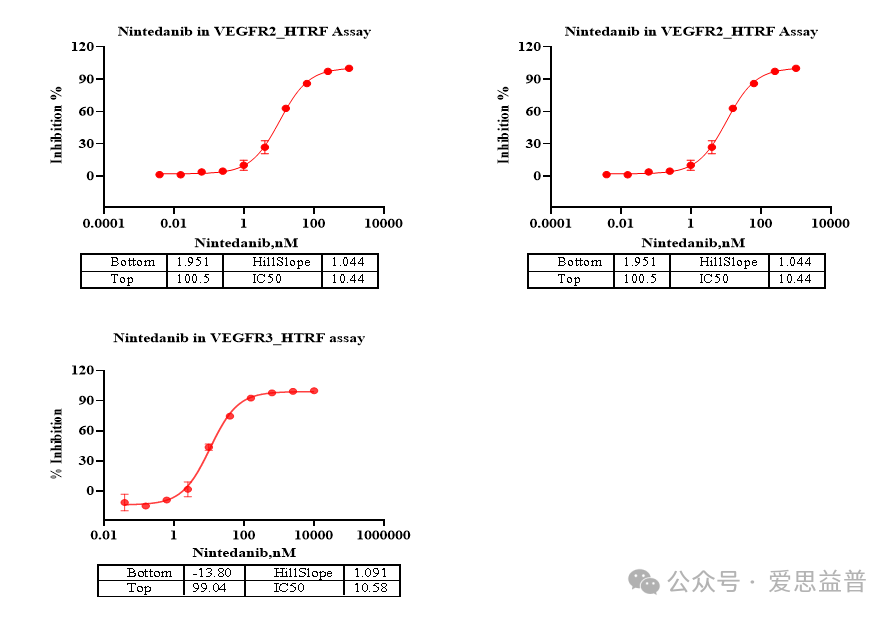
VEGFR家族
DDR家族

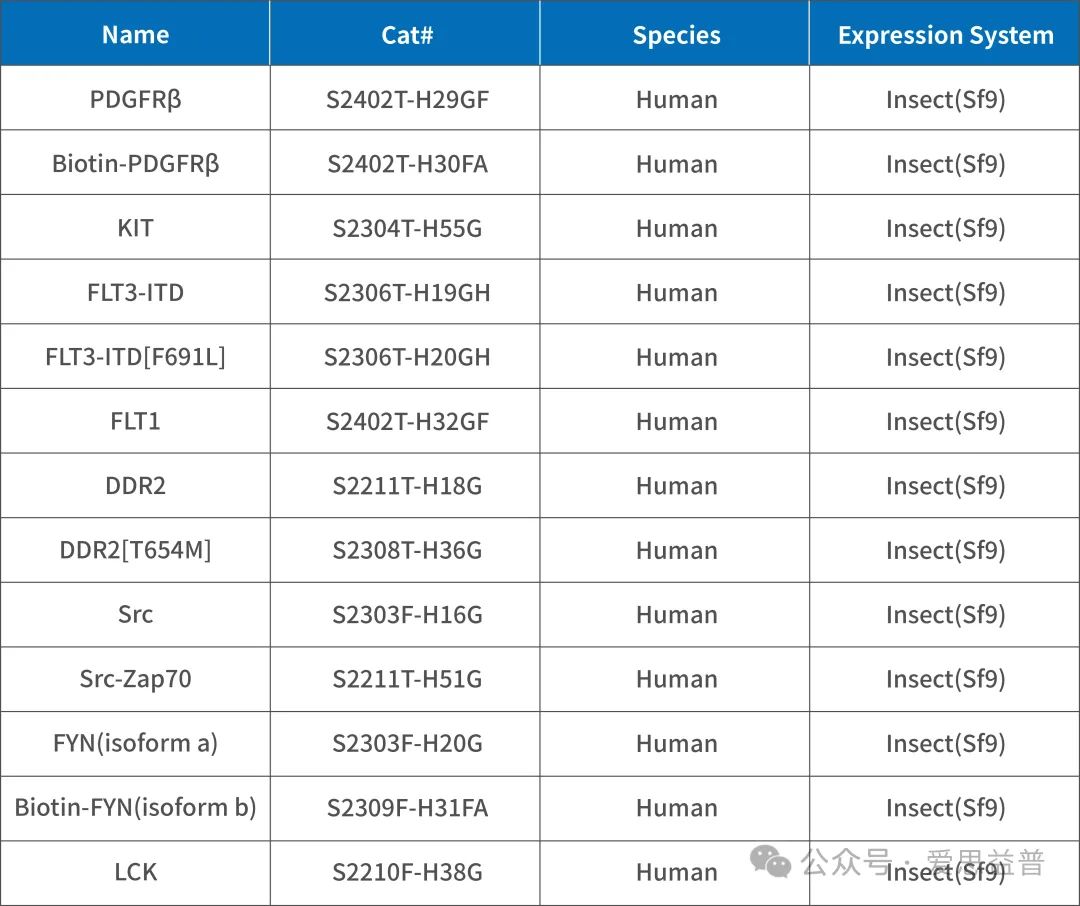
SRC家族

ICE蛋白:
更多产品信息请访问爱思益普蛋白商城查询:https://protein.ice-biosci.com/;
除了丰富的现货产品,同时可以提供克隆-表达-纯化-质控-活性测定一体化蛋白定制服务。以满足您对蛋白序列、标签或修饰以及不同应用场景的个性化需求。
小结
爱思益普团队不仅可以提供除SRC家族,PDGFR、VEGFR及DDR家族生化评价体系,同时具有丰富细胞、DMPK等研究经验,致力于在生化、ADME、PK/PD、体内药理学等生物学领域为客户提供一体化的服务。
参考文献
公司介绍
爱思益普建立的技术平台包括:
1、基于靶点的药物筛选平台:建立了超过1500种药物靶点,涵盖大多数离子通道,GPCR,激酶和非激酶靶点以及近万个实验方法,建立了从生物物理学、生物化学、细胞生物学、电生理学平台以及各种多平台和高通量筛选技术。
2、体外和体内药效筛选评价平台:包括肿瘤、免疫、心血管、中枢神经系统、代谢基于细胞、组织或动物模型的药效学评价。
3、早期成药性筛选评价平台:包括药物发现阶段ADME和PK研究,以及药物脱靶效应筛选(hERG,safety panel,激酶谱等)





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论