
▲ 高特佳行业研究专刊《高·见》第十二期已正式发布,核心报告《多领域展现巨大应用潜力,国内自免药物市场加速崛起》深入解读国内自免新药研发和技术趋势,点击文末“阅读原文”即刻阅读。
自身免疫性肾病“缺医少药”
全球创新药研发进程加速全文8000字,阅读时长10分钟
作者:肖莹|直接投资部
自身免疫性肾病是指由免疫反应异常导致肾脏损伤的疾病,其临床表现多样,可能有血尿、蛋白尿、水肿、高血压,严重时可导致肾功能不全甚至肾衰竭。肾脏是多数自身免疫疾病常见累及部位,一方面,在某些自身免疫疾病中,产生的自身抗体是针对肾脏组织中某一特定的靶抗原,自身抗体和靶抗原识别并结合后,引起了肾组织炎症和损伤,另一方面,在某些系统性的自身免疫疾病,如系统性红斑狼疮(SLE)、类风湿关节炎(RA)等,免疫复合物会在肾小球的多个部位沉积,造成病理损伤。目前常见的自身免疫性肾病包括IgA肾病(IgAN)、膜性肾病(MN)、狼疮肾炎(LN)、C3肾小球病等。IgA肾病(IgAN)是全球范围内最常见的原发性肾小球疾病,以肾小球系膜区IgA为主的沉积为主要特征。在我国,IgAN占原发性肾病约35%-50%,大多数患者在诊断后10~15年之内进展至终末期肾病。IgA肾病的发病机制,目前最为公认的是“四重打击”学说:①Gd-IgA1的生成是IgA肾病发病的源头,Gd-IgA1由肠道、扁桃体黏膜生成并进入血循环;②机体产生识别Gd-lgA1的lgG自身免疫抗体;③自身抗体与Gd-IgA1结合形成免疫复合物;④免疫复合物在肾小球系膜沉积,激活补体和炎症系统,释放醛固酮、血管紧张素Ⅱ、促炎细胞因子(白介素介素IL-6)和生长因子TGF-β,导致系膜细胞增殖和肾小球损伤,产生血尿、蛋白尿和肾功能下降。
临床实践中,IgA肾病发病初期症状不明显,患者就诊时往往已经有了显著的肾单位丢失,所以患者既有活动性免疫疾病,也有肾单位丢失的下游一般反应:全身性高血压、肾小球高滤过和蛋白尿,即慢性肾脏病(CKD)的症状。从患者数来看,据沙利文报告数据全球IgA肾病患者人数由2015年的880万人增加至2020年的930万人,其中我国约占220万人。在美国IgA肾病属于罕见病,患者基数不大,仅约13万-15万患者数。相比之下,我国确诊为IgA肾病的存量患者数百万级别,群体基数庞大。国内外指南对于原发性IgA患者,治疗方式主要是控制血压、通过抑制肾素-血管紧张素系统减少蛋白尿,以及改变生活方式等支持治疗,尽量延缓疾病进展和肾功能进一步下降。对于IgA肾病本身的病因,并没有真正有效的治疗方法。
根据《原发性IgA 肾病管理和治疗中国专家共识》,目前的治疗方式包括:
(1)生活方式干预:采取低盐(成人钠摄入<2 g/d)、减重、适度运动、戒烟等生活方式干预;建议CKD1~2期患者蛋白摄入量0.8 g/(kg·d),CKD3~5期患者蛋白摄入控制在0.6 g/(kg·d)。(2)肾素-血管紧张素-醛固酮系统阻滞剂(RAASi):蛋白尿>0.5 g/d的IgA肾病患者,无论是否伴有高血压,推荐应用RAASi,且建议滴定至可耐受最大剂量。开始或加量应用RAASi2~4周应监测血肌酐和血钾的变化。(3)钠-葡萄糖共转运蛋白2抑制剂(SGLT2i):建议选择有循证证据支持心肾获益的SGLT2i,可用于eGFR>25 mL/min/1.73m²、或eGFR≥20 mL/min/1.73m² 的成人IgAN患者,以延缓肾病进展,降低eGFR下降速率、降低尿白蛋白肌酐比(UACR),对于肾功能受损者,尤其是严重受损患者,使用SGLT2i应密切监测肾功能情况,及时停用或调整药物剂量。对已使用SGLT2i的患者,即使eGFR下降到20 mL/min/1.73m² 以下也可继续维持使用,但需密切监测肾功能情况,及时停用或调整药物剂量。(4)免疫抑制剂:糖皮质激素、环磷酰胺、羟氯喹、吗替麦考酚酯、巯唑嘌呤等。截止2024年7月,全球有2款创新药物获批:耐赋康(Nefecon)和司帕生坦(Sparsentan)。Nefecon是布地奈德肠溶胶囊,通过迟释和缓释双重创新制剂工艺,在回肠末端精准释放布地奈德,调节肠道黏膜B细胞活性,作用于“四重打击”源头,主要在第一重打击发挥作用。该产品于2021年12月在美附条件上市,随后于2023年11月在美完整获批,同月在国内获批上市。2024年5月14日,云顶新耀(2019年6月,云顶新耀引进Nefecon,获得大中华区和新加坡开发和商业化权益)宣布,Nefecon在中国首张处方成功落地。相比于全身糖皮质激素,耐赋康全身副作用更小,局部抗炎作用更强,已被KDIGO指南推荐优先/替代于全身激素类药物用于治疗IgA肾病。
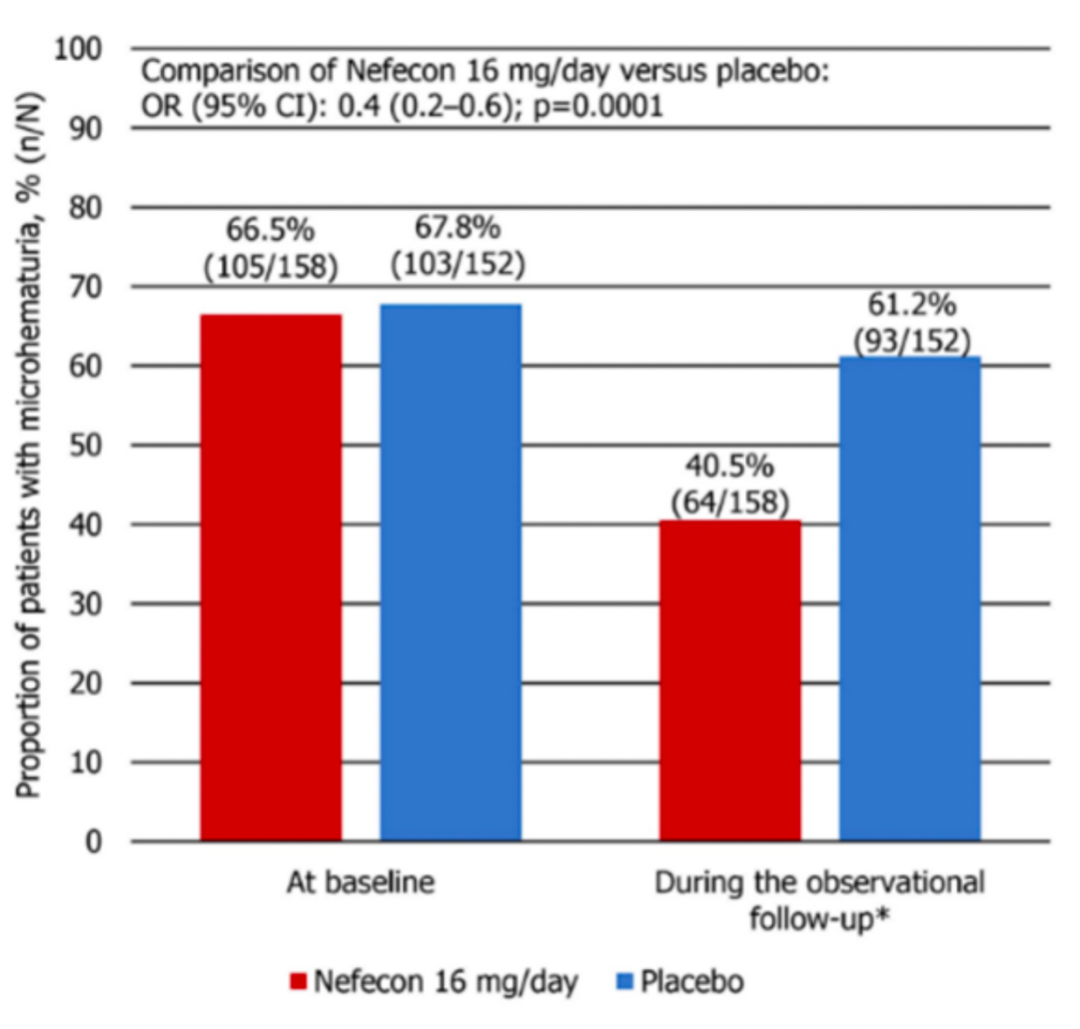
Nefecon临床3期NeflgArd整体2年数据表明,布地奈德肠溶胶囊显著改善IgA肾病患者肾功能,延缓估算肾小球滤过率(eGFR)下降,降低蛋白尿,减少血尿,且安全性良好。NeflgArd是一项全球多中心、随机、双盲、安慰剂对照的III期临床试验,该研究共纳入364例具有进展至终未期肾病风险的原发性lgA肾病患者,在已接受肾素-血管紧张素 (RAS) 抑制剂优化治疗基础上,以1:1比例随机分配至口服Nefecon (16 mg/d,n=182) 或安慰剂 (n=182) 治疗9个月,之后停药监测15个月。临床数据显示,Nefecon延缓eGFR下降速度约50%,治疗组eGFR自基线下降6.11 ml/min/1.73m²,安慰剂组自基线下降12.00 ml/min/1.73m²。Nefecon持续降低蛋白尿,最大降幅达51.3%,即使在停药后15个月仍能观察到持久效果,平均下降41%。Nefecon显著降低镜下血尿风险达60%。Nefecon治疗期间常见的治疗相关不良事件有外周水肿、痤疮、头痛、感染,没有与治疗相关的死亡报告。
Sparsentan是一种非免疫抑制的小分子,作用于内源性血管紧张素II受体和内源性内皮素I受体,调节肾脏中的肾小球滤过功能,减少蛋白尿,延缓肾脏功能的丧失。该产品于2023年2月在美加速批准(肝毒性和胚胎/胎儿毒性的黑框警告),于2024年3月提交补充新药申请。Sparsentan的三期临床PROTECT试验2年研究结果显示,与阳性对照药物厄贝沙坦相比,Sparsentan拥有更强的降蛋白尿作用。PROTECT是一项全球性、随机、双盲、平行、阳性对照的Ⅲ期试验,404例患者被随机分为2组,一组接受sparsentan(n=202)治疗;另一组接受厄贝沙坦(n=202)的治疗。临床数据结果表明,Sparsentan组的eGFR下降速率较厄贝沙坦组慢(-2.7 mL/min/1.73m²/年 vs. -3.8 mL/min/1.73m²/年)。Sparsentan在36周内显著减少了蛋白尿(49.8% vs 15.1%),而这种减少在整个研究期间保持(42.8% vs 4.4%)。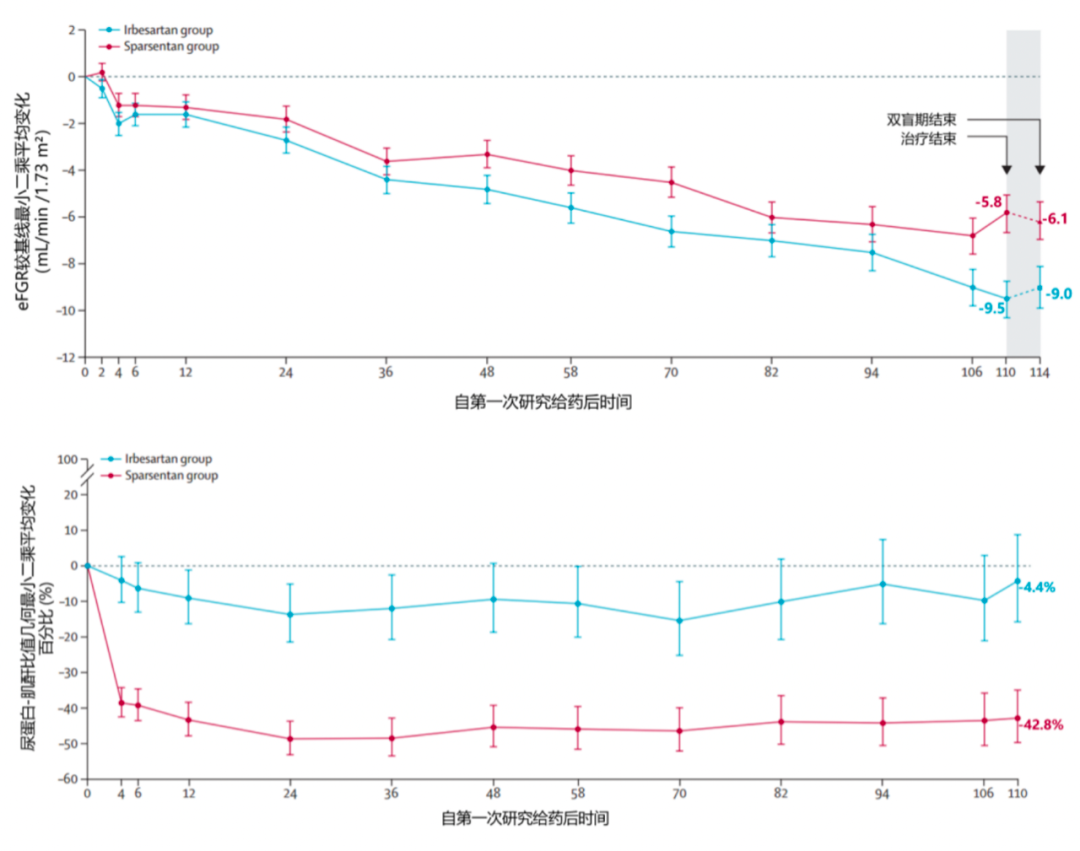
针对IgAN的创新药研发,主要围绕IgAN“四重打击”学说进行,包括减少Gd-IgA1的产生、减少致病性自身抗体的产生、抑制补体活化路径等。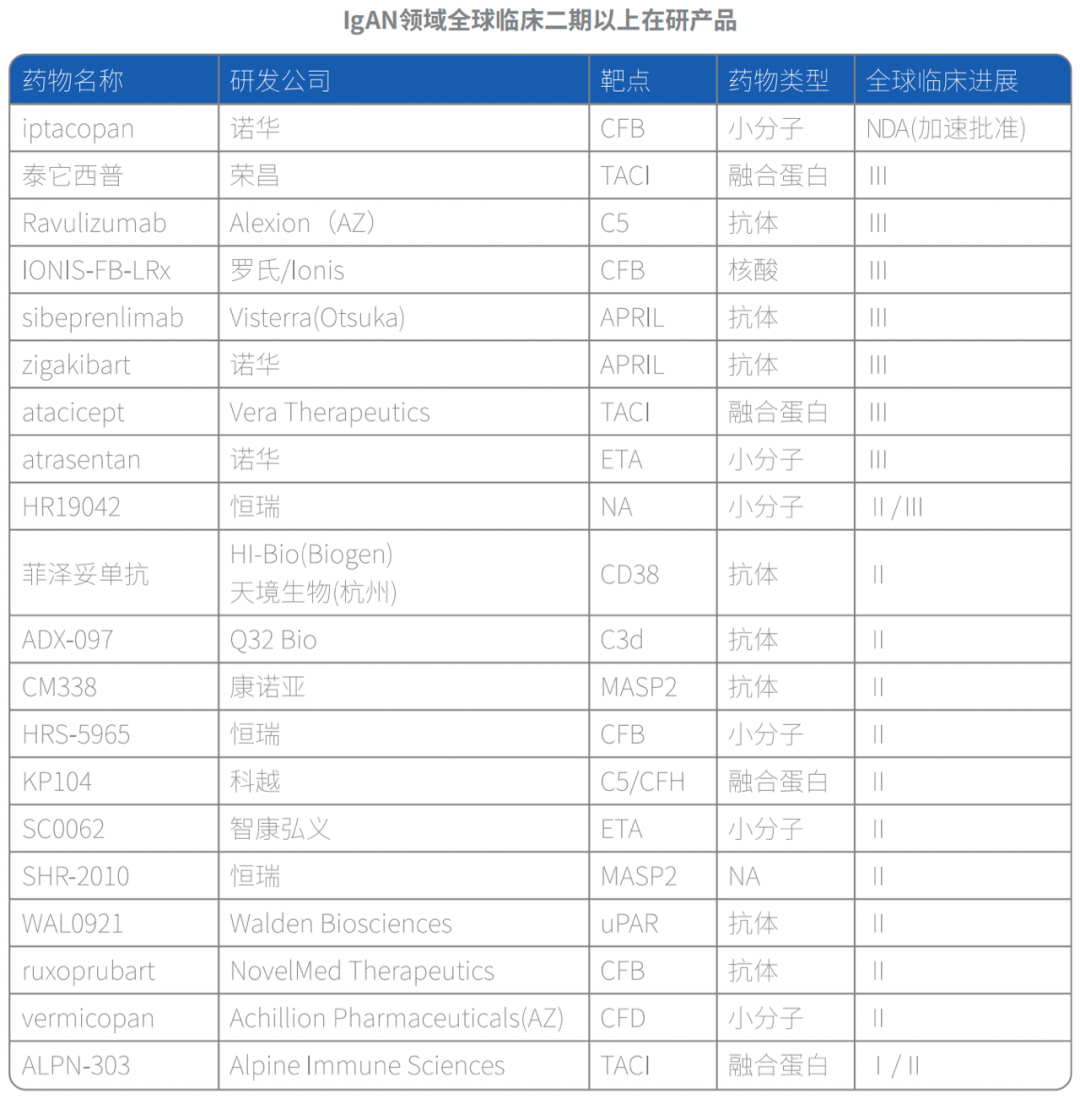
补体系统是先天免疫的重要组成部分,保护身体免受病原体侵害,同时通过消除细胞碎片和免疫复合物维持体内平衡。目前公认的补体活化途径包括经典途径、凝集素途径和旁路途径。IgAN中涉及到的补体活化途径主要为旁路途径和凝集素途径,涉及到的靶点包括MASP-2、C3、CFB、CFD、C5等。
目前进展最快的产品是诺华开发的Iptacopan(伊普可泮),一种口服靶向补体旁路途径的B因子抑制剂,目前已向FDA提交了加速批准的申请,此前于2023年12月获批用于治疗阵发性睡眠性血红蛋白尿症(PNH)。Iptacopan全球多中心临床3期中期分析数据表明,相比于安慰剂组,治疗组9个月蛋白尿减少了38.3%。Ravulizumab是由Alexion开发的下一代长效C5抗体,已经获FDA批准治疗多种自身免疫性疾病(商品名为:Ultomiris),包括阵发性睡眠性血红蛋白尿、非典型溶血性尿毒症综合征(aHUS)、重症肌无力、抗水通道蛋白4(AQP4)抗体阳性(Ab+)视神经脊髓炎谱系疾病(NMOSD)等,IgAN适应症处于临床三期阶段。Ravulizumab此前完成了120人规模的IgAN二期临床试验,与安慰剂相比,治疗组26周的蛋白尿下降了40.3%,且eGFR保持稳定。凝集素途径靶点MASP2,此前被广泛看好,代表药物Narsoplimab,全球首个获FDA授予的突破性疗法认定的IgA肾病在研药物。II期研究显示,Narsoplimab治疗可使IgA肾病患者的中位尿总蛋白水平降低64.4%,但随后其三期临床实验失败,在蛋白尿减少的评估上,Narsoplimab组与安慰剂相比并没有统计学意义上的改善。Narsoplimab的失败不能完全断定MASP-2靶点的无效,期待更多产品的临床结果公布。B细胞和浆细胞的过度激活,会影响IgA和自身抗体的产生、免疫复合物的形成及其作用,从而促进IgAN疾病的发生。BLyS和APRIL是B细胞两个重要的分子,在B细胞成熟和存活中具有重要作用。针对B细胞靶向调控,目前在研的靶点包括APRIL、TACI、CD38等,有多款产品已经进入临床三期。泰它西普是通过重组DNA技术将BAFF受体TACI胞外特定的可溶部分与人IgG1 Fc段融合的蛋白,可以阻断Blys和APRIL与细胞膜受体相互作用,目前在中美开展IgAN的临床三期试验。此前的临床二期结果表明,治疗组24周的蛋白尿下降了49%,且eGFR基本保持稳定。ALPN-303,也是一种TACI的融合蛋白,由Alpine开发,解决了WT TACI的一个关键弱点,使TACI对BAFF的亲和力提高了8~10倍,并显著提高了对APRIL的亲和力。其最新的1b/2a期数据显示,80mg剂量组在第36周时6名患者UPCR较基线降低64.1%。2024年4月,Vertex Pharmaceuticals宣布计划以49亿美元现金收购Alpine。Zigakibart是一款皮下给药的抗APRIL单抗,由Chinook Therapeutics开发,目前处于临床三期阶段。在今年的欧洲肾脏协会大会(ERA)上,公布了Zigakibart的临床I/II期研究结果,Zigakibart在治疗12周时平均蛋白尿降低率20%,在治疗24周时降低了39%,在治疗52周时降低率67%,且eGFR水平保持稳定。2023年6月,诺华宣布以高达35亿美元的价格收购Chinook,获得两项高价值的后期资产Atrasentan和Zigakibart。Felzartamab(菲泽妥单抗)是一款靶向CD38的单抗,最早由MorphoSys开发,2017年天境生物引进了该产品,获得大中华地区的权益,2022年HI-Bio与MorphoSys达成参股与授权许可协议,获得了Felzartamab在大中华区以外的全球权益。2024年5月22日,渤健宣布计划以18亿美元收购HI-Bio,获得了其核心资产Felzartamab。目前,Felzartamab用于原发性膜性肾病、抗体介导的排斥反应的II期研究已经完成,用于IgA肾病的II期研究仍在进行中。内皮素主要分为3种同工型:ET-1、ET-2、ET-3,内皮素受体分为ETA与ETB两类。ET-1与ETA受体结合后可引起入球和出球小动脉血管收缩。选择性ETA受体拮抗剂可引起入球小动脉和出球小动脉血管舒张,总体上可降低肾小球高血压和白蛋白尿。目前除了已获批的Sparsentan,临床进展最快的是诺华的Atrasentan。Atrasentan是一款高选择性ETA受体拮抗剂,其与ETA受体结合的选择性超过1800倍,减少了水钠储留的风险。该产品由Chinook Therapeutics开发,后被诺华收购,目前处于临床三期阶段。Atrasentan的临床2期数据结果显示,Atrasentan治疗治疗12周时UPCR降低48.3%,治疗24周时降低54.7%。2023年10月,诺华宣布ALIGN临床3期36周中期分析达到主要终点,研究结果表明IgAN患者蛋白尿减少具有临床意义和统计学差异。SC0062是智康弘义开发的一款高选择性ETA小分子拮抗剂,目前处于临床2期阶段。2024年7月8日,智康弘义宣布SC0062在IgAN的II期试验达到主要终点,SC0062与安慰剂组相比能够显著降低蛋白尿,且在不同剂量组间呈现出明确的剂量反应关系,结果具有临床意义和统计学意义。SC0062表现出良好的安全性,在接受SC0062治疗的患者中未观察到水钠潴留等不良反应。
膜性肾病(MN)是以肾小球基底膜(GBM)外侧、上皮细胞下免疫复合物沉积伴GBM弥漫增厚为特征的一组疾病,临床表现为蛋白尿、低蛋白血症、高脂血症和水肿,部分患者还伴随高血压、血尿等。
MN确切的发病机制尚不明确,目前比较被认可的理论主要是足细胞自身抗原诱发的机体免疫系统激活。肾小球足细胞上的抗原与其特异性抗体结合形成原位免疫复合物,后续激活补体引起足细胞损害,最终导致肾脏损伤,如肾小球硬化、肾小管间质纤维化和肾小球滤过率下降。另外,MN患者存在浆细胞异常增殖,靶向浆细胞的疗法可以阻断免疫反应的持续激活,对于减轻MN也展现了一定疗效。

在国内,MN是除IgAN之外的原发性肾小球病变主要类型,患者数量达80万人。中国的一项研究分析了2004-2014年间282个城市、938家医院涵盖所有年龄组的71151名患者的肾活检样本数据。结果显示,MN的患病率每年增加13%,而其他主要肾小球疾病的比例则保持稳定。尽管MN在临床表现上可能呈现出“良性”特征,但长期以来,它在美国和欧洲的原发性肾小球肾炎类型中一直是导致肾衰竭的第二或第三大原因。对于持续患有肾病综合征的MN患者,有40-50%的人在10年内会出现肾衰竭。
3.2 现有治疗方式
根据KIDGO指南,所有存在蛋白尿的原发性MN患者均应接受优化支持治疗,免疫抑制治疗应仅限于存在肾功能损伤进展风险的患者。优化支持治疗包括严格限纳(<2 g/d );限制蛋白摄入(0.8-1 g/kg/d);控制血压(收缩压<120 mmHg)、高脂血症和水肿;RAS阻断剂滴定至最大耐受剂量或允许的最大每日剂量。免疫抑制治疗包括环磷酰胺、糖皮质激素、钙调磷酸酶抑制剂(CNIs)、利妥昔单抗(RTX)等。
对于MN患者的治疗,首先要进行风险评估,确定其风险等级。对于低风险患者,应进行等待和观察。对于存在至少1项疾病进展危险因素的MN患者,建议使用利妥昔单抗或环磷酰胺联合激素治疗6个月,或以他克莫司为基础的至少6个月的治疗,根据风险评估选择治疗策略。对大多数患者而言,利妥昔单抗成为一线治疗方案(初治、复发、抵抗等)。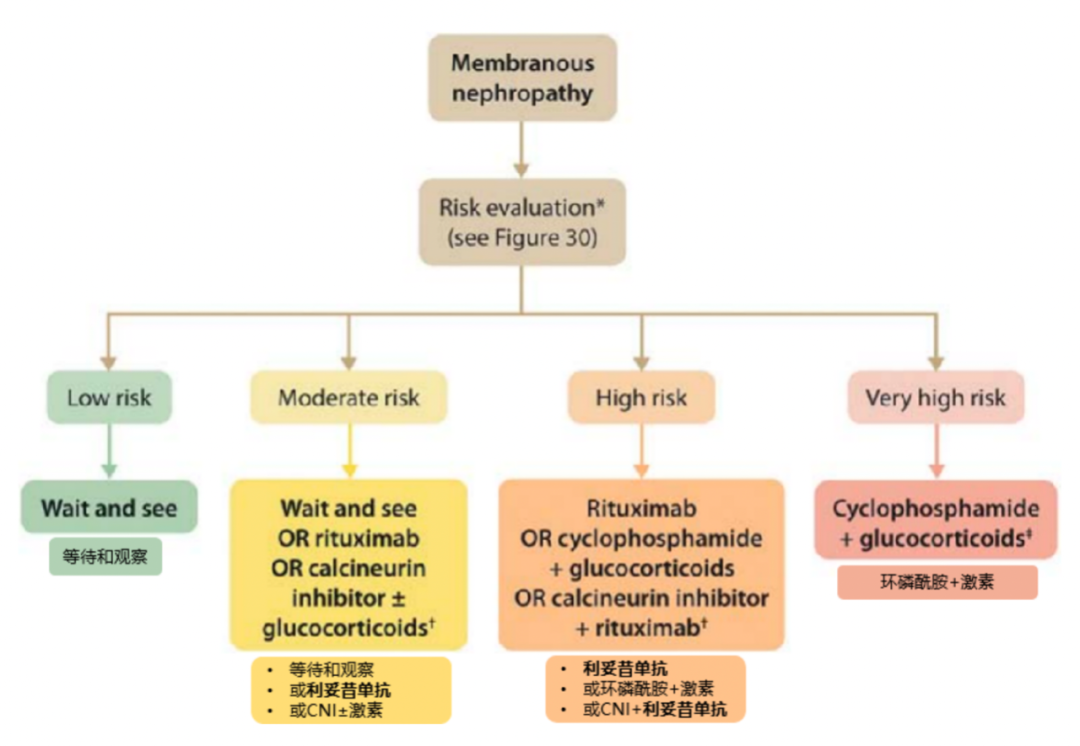
全球来看,MN并未有针对性的创新药物获批,目前临床上使用较多的利妥昔单抗,也并未获批该适应症,属于超适应症使用。利妥昔单抗是一款抗CD20抗体,通过特异性结合B细胞表面的CD20抗原,减少B细胞数量,从而降低免疫复合物的产生,改善疾病进程。在GEMRITUX研究中,评估了RTX组(利妥昔单抗+支持治疗)和对照组(支持治疗)的治疗效果,经过6个月的治疗后,RTX组缓解率达到35%,优于对照组的21%。MENTOR研究则比较了RTX与环孢素在治疗膜性肾病方面的效果。结果显示,RTX在诱导12个月蛋白尿完全缓解或部分缓解方面不劣于环孢素(60% VS 52%),对于持续进展的高风险患者,RTX在维持蛋白尿长达24个月的缓解率方面显著优于环孢素(60% VS 20%,p<0.001)。3.3.2 在研创新药物
全球在研产品靶点主要聚焦在CD20、CD38、BTK等,进展最快的为两款CD20的单抗。

目前全球来看,进展最快的MN在研药物为CD20单抗,罗氏的奥妥珠单抗和天广实的MIL62均处于临床三期阶段。奥妥珠单抗是一款经糖基化改造的人源化Ⅱ型CD20单抗,其在Fc段的糖基化修饰可增强其与免疫效应细胞的亲和力,从而增强抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞介导的吞噬作用。与RTX相比,奥妥珠单抗具有更强的ADCC作用、更好的直接杀伤B细胞作用、更少依赖于补体依赖性细胞毒性(CDC)和更低的免疫原性风险。奥妥珠单抗此前已被获批用于治疗慢性淋巴细胞白血病、滤泡性淋巴瘤和小淋巴细胞性淋巴瘤。MIL62也是一种人源化Ⅱ型CD20单抗,采用了岩藻糖全敲除技术增强ADCC作用,是国内首款针对肾病治疗纳入突破性疗法的国产药物。与利妥昔单抗相比,MIL62的独特结合表位及抗体糖基化修饰显示出更强的ADCC活性。2023年第60届欧洲肾脏协会大会(ERA),天广实口头报告了MIL62治疗原发性膜性肾病的Ib/II期临床数据,相比于环孢素对照组,MIL62治疗组12周将免疫缓解率从52.2%提高到88.2%(p=0.001),免疫响应时间从1.8个月缩短到1.3个月。MIL62治疗组24周肾脏总体缓解率从34.8%提高到62.7%(p=0.025),响应时间从5.1个月缩短到4.6个月。菲泽妥单抗在MN适应症上已被FDA授予突破性疗法认定。在2023年11月美国肾脏病学会公布了菲泽妥单抗的一项Ib/IIa期、开放标签、国际多中心临床研究,结果显示,74%(23/31)患者部分免疫缓解(血PLA2R抗体下降≥50%),26%(8/31)患者达到完全免疫应答。47%的新诊断或复发患者和18%的难治性患者在12个月达到蛋白尿部分缓解,没有患者达到完全缓解。BTK(布鲁顿酪氨酸激酶)是B细胞受体信号通路中的关键激酶,BTK的异常活化会导致B细胞受体信号通路过度活跃。在MN领域,目前进展最快的BTK抑制剂是百济神州的泽布替尼,目前处于临床Ⅱ/Ⅲ期阶段。此前,泽布替尼已获批套细胞淋巴瘤、小淋巴细胞性淋巴瘤、慢性淋巴细胞白血病、滤泡性淋巴瘤等适应症。狼疮性肾炎(LN)是系统性红斑狼疮(SLE)常见且严重的并发症,大多数SLE患者在诊断后5年内出现LN,LN也是诊断SLE的主要临床表现之一。约40%-60%的SLE患者起病初即有狼疮肾炎,复发率高达33%-40%,每一次的复发均可能会导致器官损伤的进一步加重。在最初诊断为SLE的10年内,5-20%的LN患者发展为终末期肾病(ESKD)。LN是自身抗体和免疫复合物(ICs)的沉积,免疫细胞浸润和肾脏固有细胞的活化和/或增殖,导致损伤部位存在多种致病分子引发肾脏炎症。SLE患者体内的一些细胞的DNA受损,随后死亡细胞的内部(DNA、组蛋白和其他蛋白质等)会暴露出来,激活了内体(例如TLR7、TLR8和TLR9)以及先天免疫细胞和B细胞,产生了I型干扰素(IFN-I)及各种促炎细胞因子。同时,T细胞亚群中的T滤泡辅助细胞(Tfh)激活生发中心B细胞以产生自身抗体,与靶抗原结合,在原位或循环中形成ICs,驱动肾损伤。另外,补体也参与LN的发病机制。
狼疮肾炎治疗包括基础治疗和免疫抑制剂,基础治疗以羟氯喹为主。免疫抑制剂包括吗替麦考酚酯、麦考酚钠(疗效与吗替麦考酚酯相当),环磷酰胺、硫唑嘌呤,钙调神经磷酸酶抑制剂(环孢素或他克莫司)、糖皮质激素等。对于Ⅰ型和Ⅱ型狼疮肾炎,考虑使用低剂量糖皮质激素与其他免疫抑制剂进行维持期联合治疗。对于活动性III或IV型狼疮肾炎,初始治疗推荐糖皮质激素基础上加用霉酚酸类似物(MPAA)、或低剂量静脉注射环磷酰胺、或贝利尤单抗联合MPAA或低剂量静脉注射环磷酰胺等。在完成初始治疗后,患者应继续使用MPAA作为维持治疗。对于V型狼疮肾炎,首选血管紧张素转化酶抑制剂(ACEI)/血管紧张素受体拮抗剂(ARB)类药物降尿蛋白治疗,出现蛋白尿进展时加用免疫抑制剂。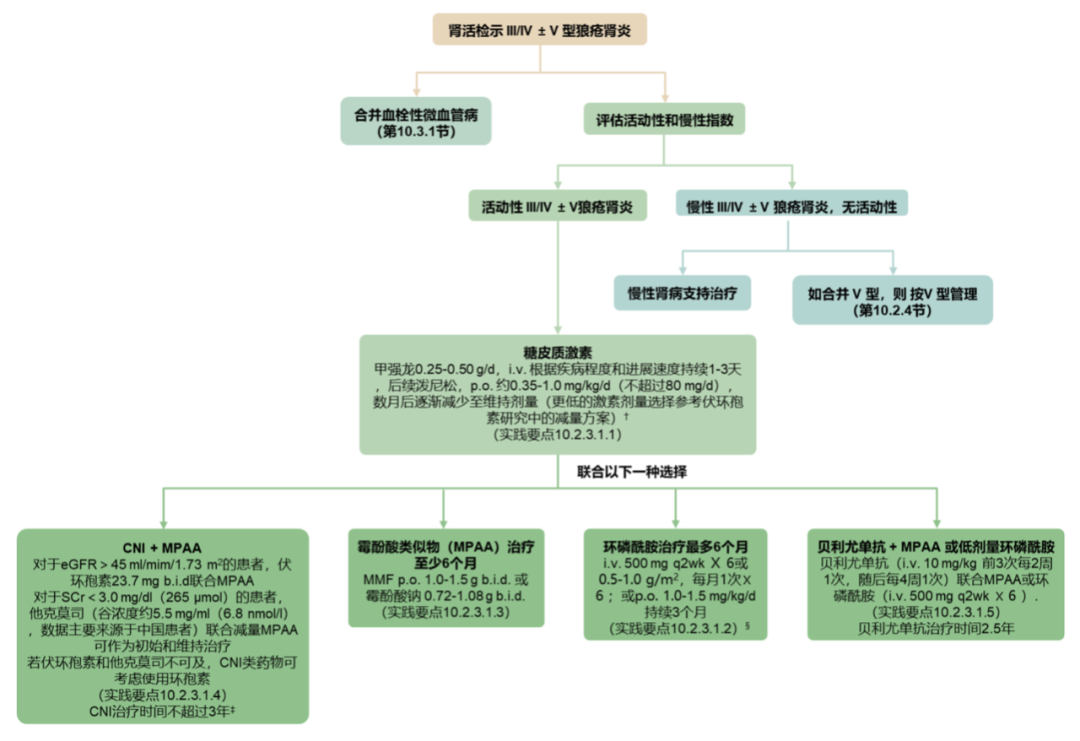

贝利尤单抗是一款靶向BAFF的抗体,通过与B细胞上的受体结合,抑制B细胞存活,减少自身抗体的生成。贝利尤单抗是过去50年FDA批准的第一个治疗SLE的药物,也是全球首款用于治疗LN的生物制剂。BLISS-LN研究是针对活动性狼疮肾炎全球规模最大、历时最长的3期临床试验,共入组448位患者,研究进行了2年(104周)。数据结果显示,贝利尤单抗组达到主要疗效终点肾脏缓解(PERR)的患者比例较安慰剂组显著增高(43% VS 32%),同时,在所有四个关键次要终点的数据上,贝利尤单抗组较安慰剂组均显示出具有统计学意义的改变。
全球二期以上的在研靶点主要包括靶向B细胞途径、补体途径、干扰素和细胞因子途径。
靶向B细胞途径的在研靶点包括CD20、BAFF、TACI等,与IgAN、MN类似,通过抑制这些靶点,消除B细胞,减少自身抗体的产生。进展最快的包括奥妥珠单抗和ianalumab,处于临床三期。Ianalumab是一种新型的去岩藻糖基化的人类免疫球蛋白(Ig)G1单克隆抗体,靶向肿瘤坏死因子家族的B细胞活化因子受体(BAFF-R)。在今年的EULAR公布了Ianalumab最新的治疗SLE的二期数据结果,在第28周,接受Ianalumab治疗或安慰剂治疗达到SRI-4+CS应答者复合终点标准的患者比例分别为44.1%(n/N=15/34)和9.1%(n/N=3/33)。Ianalumab在LN适应症上的数据结果暂未公布。奥妥珠单抗在LN适应症上的二期临床结果显示,相比安慰剂组,奥妥珠单抗组患者在第52周[22(35%)VS 14(23%)]与第104周[26(41%)VS 14(23%)]时的CRR比例明显较高,达到研究主要终点与关键次要终点,且安全性良好。Ⅰ型干扰素信号传导途径在SLE/LN的发病机制中扮演重要角色。在LN患者中,60-80%患者有Ⅰ型干扰素高表达的特征。Anifrolumab是一种抗IFNAR1(Ⅰ型干扰素受体)的人单克隆抗体,由AZ研发,目前处于临床三期阶段。Anifrolumab在LN适应症上的Ⅱ期TULI-PLN研究虽然没有达到主要终点,但高剂量组患者的肾脏完全缓解率为46%,支持其开展三期试验。补体在系统性红斑狼疮的发病机制中起到关键作用。一方面,补体蛋白缺陷或水平低下情况下个体易患狼疮;另一方面,补体活化的直接作用及其影响免疫细胞功能的间接作用可加重狼疮患者的病理损害,促进狼疮的病程发展。目前在研的补体相关靶点包括CFB、C5、C3d、CFD等,目前都处于二期阶段,暂未有相应临床数据结果公布。IL-17参与SLE的多种病理途径,导致B淋巴细胞的活化和自身抗体的产生等,最终导致肾小球损伤和炎症的持续存在。此前司库奇尤单抗(IL-17A抗体)开展了一项随机、双盲、平行组、安慰剂对照的Ⅲ期临床研究,旨在评估皮下注射(s.c.)300mg司库奇尤单抗联合SoC,相比安慰剂联合SoC在活动性LN患者中的疗效、安全性和耐受性,但该研究因无效分析而提前终止。目前还有2款国产IL-17A抗体在开展LN的二期临床试验,期待后续的临床结果公布。干细胞和CAR-T疗法目前在探索LN领域的治疗作用,已有多款CAR-T和干细胞产品进入临床阶段。目前进展较快的是睿源生物的RY_SW01,处于临床二期阶段。RY_SW01属于间充质干细胞治疗产品,通过调节各种免疫细胞的功能,纠正免疫失衡,诱导免疫耐受,进行组织修复从而达到对LN的治疗作用,较传统的一线方案能显著降低毒副作用。
2001年高特佳投资在深圳成立,率先在业内提出“主题行业投资”的投资模式,专注医疗健康产业投资,以战略性股权投资为主导,投资覆盖并购、PE、VC、天使等全阶段。拥有国内为数不多的深度聚焦医疗健康赛道的专业投资团队,构建医疗健康产业投资生态平台,致力于成为具有全球影响力的医疗健康投资机构。
资产管理规模超200亿元,医疗健康产业基金35支,先后投资170余家企业,其中医疗健康企业超110家。高特佳投资业务立足中国,面向全球,在深圳、上海、北京、香港等地建立运营中心,致力于在全球范围内投资优秀医疗健康企业,为全球资本和医疗企业嫁接中国动力,协助创业者成就伟大企业。
<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。
























































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论