 关注小药说药,一起成长!
关注小药说药,一起成长!
近年来,嵌合抗原受体(CAR)T细胞疗法治疗血液恶性肿瘤成为细胞治疗的一项重大突破。迄今为止,美国食品和药物管理局(FDA)已经批准了六种CAR-T疗法,用于治疗非霍奇金淋巴瘤、B细胞急性淋巴细胞白血病和多发性骨髓瘤。
目前,注册的大多数临床试验都基于所谓的第二代CAR,其由一个细胞外抗原结合区、一个共刺激域和一个CD3z信号域组成。不幸的是,尽管总体治疗效果显著,但仍有相当高比例的患者没有从CAR-T治疗中获益,总体应答率在50%至100%之间,由于应答的持久性有限,后续复发率高达66%。此外,它还与细胞因子释放综合征和神经毒性等不良反应有关。
免疫学和分子工程的进展推动了新一代CAR-T细胞的构建,这些细胞武装了各种分子机制,包括额外的共刺激域、安全开关、免疫检查点调节、细胞因子表达或治疗干扰分子的敲除等。从而可以克服CAR-T疗法当前的局限性,增强疗效并减少不必要的副作用。目前,许多临床试验目前正在评估新型CAR-T疗法的安全性和有效性。
随着CAR-T细胞技术越来越成熟,CAR结构的组成,特别是细胞内结构域也在不断进化。第一代CAR-T细胞结构包含肿瘤相关抗原的高亲和力单链抗体(scFv)、跨膜结构域和唯一的细胞内TCR-ζ或FcR-γ结构域。G1 的临床益处有限,主要是由于其增殖能力低和体内细胞毒性有限。为了克服这一缺点,第二代CAR结构配备了额外的细胞内共刺激结构域,最显著的是CD28或TNFRSF成员4-1BB。这些CARs被证明是非常有效的,几种CAR-T产品在治疗血液瘤方面获得了监管部门的批准。

第三代CAR-T结构包含了共刺激结构域的组合,而第四代和第五代CAR-T细胞包含额外的共刺激结构域,在抗原识别时诱导表达细胞因子(例如IL-12),或包含某些细胞因子受体的细胞内结构域(例如,截短的IL-2受体β链和STAT3结合部分)。
CAR-T治疗中的免疫检查点调节旨在规避抑制性的肿瘤微环境。在血液肿瘤方面,评估该方法的所有临床试验都明确依赖于破坏程序性细胞死亡蛋白1(PD-1)途径。尽管试验数量相对较少(n=8),但个别研究显示了调节PD-1信号的独特方法。
在NCT03258047临床试验中,研究人员使用了一种创新方法,其中PD-1融合到细胞内CD28激活域。因此, PD-L1与PD-1的结合转化为激活信号,预期会产生更有效的抗肿瘤效果。该研究涉及17名患有B细胞非霍奇金淋巴瘤的受试者。结果显示,完全缓解率(CR)和客观缓解率(ORR)分别为41.2%和58.8%。与已批准的复发/难治性(r/r)DLBCL的第二代CAR-T疗法相比(CR 52%,ORR 72%),没有显示出优势。此外,NCT03932955临床试验正在研究相同的免疫检查点调节方法,目前没有任何结果。
破坏PD-1信号的另一种探索方法是重编程CAR-T细胞以分泌PD-1-Fc融合蛋白。目前,两项研究正在评估这种方法在r/r多发性骨髓瘤(NCT04162119)和r/r B细胞淋巴瘤(NCT0416 3302)中的安全性和有效性。然而,目前尚未发表任何临床数据。
在临床试验NCT04836507中,研究人员在r/r大B细胞淋巴瘤(LBCL)患者中测试了anbalcabtagene autoleucel (Anbal-cel)。这种新型CAR-T细胞产品敲除PD-1和TIGIT受体。Anbal-cel显示出令人印象深刻的结果,CR为78%。此外,还在NCT03208556临床试验中评估了PD-1的敲除。
除PD-1通路调节外,NCT04037566临床试验正在评估另一种武装CAR-T细胞构建。造血祖细胞激酶1(HPK1)表达降低的CAR-T细胞——一个阴性的细胞内免疫检查点,显示了有希望的初步结果。在所有入选患者中,72.7%的患者达到CR或CRi,与FDA批准的抗CD19疗法相当。
TRUCKs–表达细胞因子的CAR-T细胞
重定向用于通用细胞因子介导杀伤的T细胞(TRUCKs)是新一代CAR-T细胞,被设计为表达某些细胞因子,以增强CAR-T细胞的抗肿瘤效力,提高其持久性,并改变肿瘤微环境的特征。
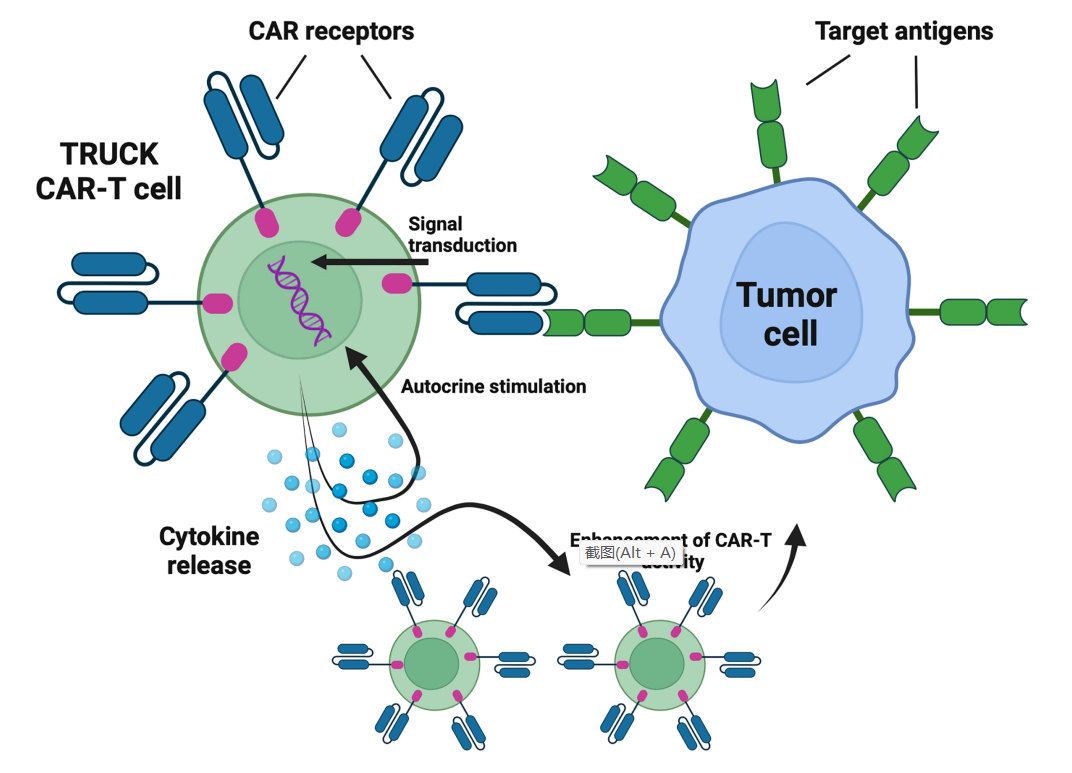
目前,六项临床试验正在评估TRUCKs治疗血液系统恶性肿瘤。四项临床试验(NCT04381741、NCT03929107、NCT04833504、NCT03778346)正在评估表达IL-7和趋化因子CCL19的CAR-T细胞。IL-7促进T细胞的增殖和存活,而CCL19引导CAR-T细胞的肿瘤归巢。研究结果显示, r/r DLBCL的患者的CR率为4/7,ORR为5/7。此外,NCT03778346在r/r多发性骨髓瘤(MM)患者也探索了相同的方法,其中两名入选患者获得了CR(100%)。
另一种分泌细胞因子IL-18的CAR-T细胞正在NCT04684563临床试验中进行评估。IL-18在CAR-T细胞中表达以增强CAR-T细胞增殖和抗肿瘤活性。然而,IL-18也与肿瘤进展相关,因此,关于表达IL-18的CAR-T细胞在临床中的安全性的长期结果有待观察。
NCT03602157临床试验代表了在CAR-T细胞中利用细胞因子信号的不同方法。研究人员构建了一种表达CCR4的抗CD30 CAR-T细胞,用于治疗r/r霍奇金淋巴瘤和皮肤T细胞淋巴瘤(CTCL)。该受体与CCL17结合,进而改善CAR-T细胞向肿瘤部位的运输。霍奇金淋巴瘤队列试验的初步结果是乐观的,6名入选患者获得CR(75%),而所有患者均获得ORR(100%)。不幸的是, CTCL组没有人获得缓解。
常规CAR-T疗法伴随的治疗相关毒性促进了安全开关CAR-T细胞的构建。新技术使研究人员能够结合安全开关,通过在给予外源药物后诱导细胞凋亡、补体依赖性细胞毒性(CDC)或抗体依赖性细胞细胞毒性(ADCC)来清除CAR-T细胞。

将截短的表皮生长因子受体(EGFRt)结合到CAR-T细胞中是临床试验中常见的安全开关方法。EGFRt被cetuximab靶向,其能够通过CDC或ADCC去除。截至2022年8月,20项临床试验正在研究多种血液系统恶性肿瘤中基于EGFRt的CAR-T细胞。目前,没有关于在人体中启动EGFRt安全开关机制的可用数据。缺乏此类报告的原因可能是调查期间没有危及生命的不良事件。
在药效方面,在CD19阳性的恶性肿瘤中,临床试验显示了不同的初步结果。NCT03085173研究报告的总CR率为57%,DLBCL患者的CR率为88%,而CLL患者为22%。在关于B-NHL患者的临床试验中,NCT02706405的完全应答率为42%,NCT02153580中为45%,NCT01815749中为75%。
RQR8自杀基因是治疗给药后控制CAR-T细胞的类似方法。RQR8基因编码源自CD20和CD34抗原表位的细胞表面蛋白。该策略能够在给予rituximab后通过CDC或ADCC清除CAR-T细胞。目前,NCT03590574临床试验正在研究外周T细胞淋巴瘤(PTCL)中基于RQR8的CAR-T细胞。初步结果显示,ORR为67%,56%的患者实现了完全代谢反应(CMR)。另一项试验NCT03287804因治疗多发性骨髓瘤的初步疗效不理想而终止。
诱导型半胱天冬酶9(iCasp9)的加入是CAR-T安全开关的一种独特方法。在给予AP1903后,特别修饰的胱天蛋白酶9发生二聚并触发凋亡途径。目前,17项临床试验正在评估基于iCasp9的CAR-T细胞,但其中只有4项提供了初始数据。NCT03016377临床试验报告了一例ALL患者在CAR-T输注后出现神经毒性。AP1903给药后,症状完全缓解,唯一的不良事件是持续三天的2级胆红素升高。有趣的是,尽管消除了90%以上的CAR-T细胞,研究人员仍观察到临床上显著的抗白血病反应。在NCT02274584试验中,仅发表了一例霍奇金淋巴瘤患者的病例报告,显示暂时部分缓解。此外,NCT03125577试验报告了4名患者的数据,所有患者在CAR-T输注后出现CR。
另一种可作为CAR-T疗法安全开关的自杀基因是单纯疱疹病毒胸苷激酶(HSV-TK)Mut 2基因,其产物被前药更昔洛韦(GCV)靶向。HSV-TK将GCV转化为GCV三磷酸,通过破坏复制过程导致细胞死亡。在终止的NCT04097301试验中评估了基于HSV-TK的CAR-T细胞。最终,只有两名患者入选,且对治疗无反应。由于缺乏T细胞相关毒性,安全开关未被激活。
如今,传统CAR-T产品是由来自符合治疗条件的患者的自体T细胞制造的。该方法存在若干局限性,包括制造时间长、难以动员适当数量的T细胞以及严重治疗患者的T细胞质量降低。然而,利用分子工程产生异基因CAR-T细胞可以克服上述障碍。为了构建通用CAR-T,需要从供体来源的细胞中去除主要组织相容性复合物(MHC)和T细胞受体(TCR)分子。

CRISPR/Cas9技术在T细胞工程中的初步安全性和可行性已在首次人体试验NCT03399448中得到证实。截至2022年8月,在ClinicalTrials.gov上已注册了5项评估抗自相残杀CAR-T细胞的临床试验。在NCT04502446中,针对CD70抗原的CAR-T细胞被设计为消除TCR、MHC-I和CD70的表达,以消除自相残杀并提高疗效。结果显示,ORR为47%,而CR为20%,未观察到严重不良事件。此外,NCT04264078试验提供了在r/r T-ALL患者中使用通用CAR-T细胞的数据。通过CRISPR/Cas9破坏TCR和CD7基因,以防止GvHD和自相残杀。结果显示,CR为80%(4/5),但所有受试者的治疗均与严重CRS相关(4名患者为3级,1名患者为4级)。后续入选患者的结果证实了该治疗的高疗效,CR为83%(5/6),而安全性结果与先前观察结果一致。
随着研究数据的积累和分子工程的广泛应用,新一代CAR-T细胞治疗在临床上逐渐趋于成熟。最成功的新一代CAR-T细胞有可能是通用同种异体CAR-T细胞(使用CRISPR/Cas9技术制造),其特征在于免疫检查点抗性,并表达将T细胞运输到肿瘤部位的细胞因子。此外,这种结构将包含用于管理潜在毒性的安全开关机制。这种组合可能克服CAR-T细胞疗法当前的局限性,并有助于改善患者的治疗结果。
参考文献:
1.Next generations of CAR-T cells - new therapeutic opportunities in hematology? Front Immunol.2022 Oct 28;13:1034707.
公众号内回复“肿瘤免疫”或扫描下方图片中的二维码免费下载《小药说药肿瘤免疫全集》的PDF格式电子书!

公众号已建立“小药说药专业交流群”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论