
2024年欧洲肿瘤内科学会(ESMO)年会上,中国生物制药1类创新药安罗替尼联合贝莫苏拜单抗用于晚期肾细胞癌(RCC)一线治疗的III期临床研究(ETER100)最新成果入选“最新重磅摘要”(LBA),并以小型口头报告(Mini Oral)形式进行报告。研究结果显示,安罗替尼联合贝莫苏拜单抗治疗组中位无进展生存期(PFS)显著延长至18.96个月,客观缓解率(ORR)提升至71.6%,总生存期(0S)呈获益趋势。此前,该新适应症上市申请已获得中国国家药品监督管理局药品审评中心(CDE)受理,这也是国内首次使用双国产创新药组合一线免疫治疗晚期肾细胞癌。


肾细胞癌(RCC)是最常见的泌尿系统肿瘤之一[1-2]。约20-30%的肾癌患者诊断时已出现局部或远处转移[3-5],对于原发性非转移的肾细胞癌患者,即使接受治愈性为目的的肾切除术,仍然会有约20%的患者5年内出现复发或转移性[6-10]。
ETER100研究(NCT04523272)是一项随机、开放、阳性药物平行对照、多中心的III期临床研究,旨在评估贝安罗替尼联合贝莫苏拜单抗对比对照组一线治疗晚期不可切除或转移性RCC的有效性和安全性。北京大学肿瘤医院郭军教授和中国医学科学院肿瘤医院周爱萍教授牵头开展了该研究,以进一步探索晚期肾细胞癌一线治疗的有效方案。
安罗替尼联合TQB2450对比舒尼替尼一线治疗晚期肾细胞癌(RCC)—一项随机对照、开放、III期研究(ETER100)

ETER100最新研究数据[11]显示,安罗替尼联合贝莫苏拜单抗组(下称试验组)和对照组的中位PFS分别为18.96个月和9.76个月,试验组显著延长了患者的PFS(图1左)。大部分亚组显示可从安罗替尼联合贝莫苏拜单抗治疗中获得显著PFS获益(图1右)。提示安罗替尼联合莫苏拜单抗有望在临床上延长肾细胞癌患者的生存获益。
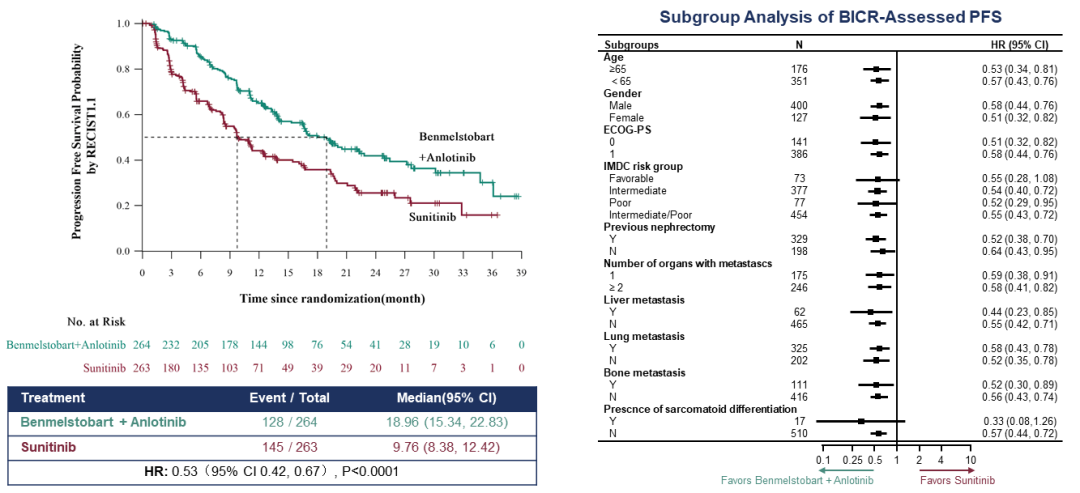
图1 BICR评估的PFS曲线图(左)及亚组分析(右)
相对于对照组,试验组显著提高患者ORR,试验组ORR为71.6%,对照组ORR为25.1%(图2左)。此外,试验组显示出OS获益趋势(图2右)。
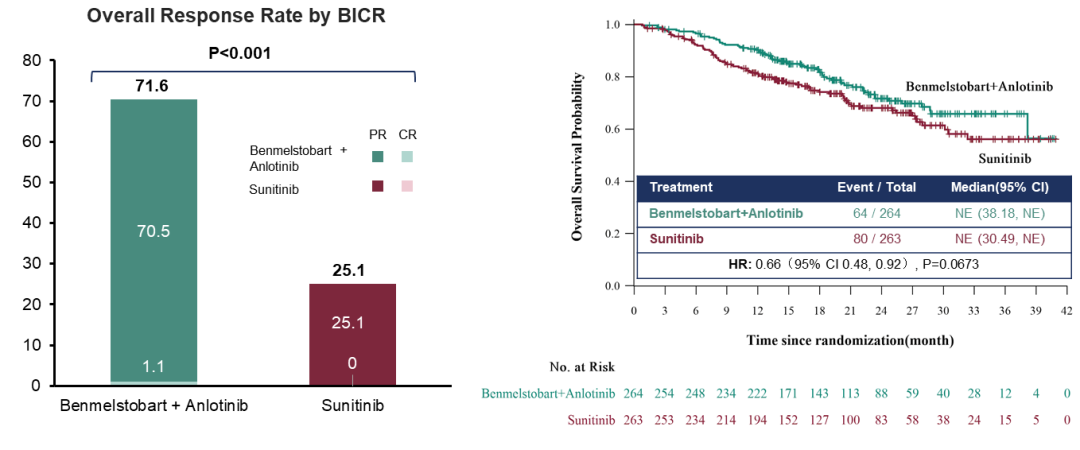
图2 客观缓解率(左)和OS曲线图(右)
此前,国家药品监督管理局药品审评中心(CDE)官网显示,安罗替尼联合贝莫苏拜单抗用于一线治疗晚期不可切除或转移性肾细胞癌的新适应症上市申请已获受理,这是盐酸安罗替尼胶囊申报上市的第八个适应症,是贝莫苏拜单抗注射液申报上市的第三个适应症。LBA是ESMO科学委员会从海量稿件中筛选的高质量、高水平、有望改变肿瘤领域临床实践或阐述疾病重要机制的随机II、III期研究成果。安罗替尼联合贝莫苏拜单抗有望延长肾细胞癌患者的生存获益,成为晚期肾细胞癌新的一线标准治疗方案。
肿瘤领域是中国生物制药的重点治疗领域之一,随着公司在肾癌领域的不断探索,创新成果正逐渐显现。会上,中国生物制药还公布了派安普利单抗辅助治疗肾癌的最新进展。未来,公司将继续以未被满足的临床需求为导向,不断开拓创新,为更多肾癌患者带来福音。
▲ 上下滑动查看更多
声明:
1. 本新闻稿旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参阅,非广告用途。
2. 本公司不对任何药品和/或适应症作推荐。
3. 本新闻稿中涉及的信息仅供参考,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。若您想了解具体疾病诊疗信息,请遵从医生或其他医疗卫生专业人士的意见或指导。
前瞻性声明:
本新闻稿中包含若干前瞻性陈述,包括有关【盐酸安罗替尼胶囊、贝莫苏拜单抗注射液】的临床开发计划、临床获益与优势的预期、商业化展望、患者临床获益可能性,以及潜在商业机会等声明。“预期”、“相信”、“继续”、“可能”、“估计”、“期望”、“有望”、“打算”、“计划”、“潜在”、“预测”、“预计”、“应该”、“将”、“拟”、“会”和类似表达旨在识别前瞻性陈述,但并非所有前瞻性陈述都包含这些识别词。这些前瞻性陈述为公司基于当前所掌握的数据和信息所做的预测或期望,可能因受到政策、研发、市场及监管等不确定因素或风险的影响,而导致实际结果与前瞻性陈述有重大差异。请现有或潜在的投资者审慎考虑可能存在的风险,并不可完全依赖本新闻稿中的前瞻性陈述,该等陈述包含信息仅及于本新闻稿发布当日。除非法律要求,本公司无义务因新信息、未来事件或其他情况而对本新闻稿中任何前瞻性陈述进行更新或修改。
内容来源:中国生物制药有限公司于香港联交所发布的公告、中国生物制药有限公司官网、正大天晴药业集团公众号

双终点阳性!中国生物制药安罗替尼联合派安普利单抗一线治疗晚期肝癌取得重要突破
首登顶级学术盛会+新剂型获批临床 中国生物制药呼吸领域1类新药PDE3/4抑制剂喜讯连连
客观缓解率81.08% 中位PFS达17.25个月 中国生物制药1类新药安奈克替尼ROS1阳性肺癌II期数据刷新
中位总生存期达28.9个月!中国生物制药去化疗联合疗法为EGFR-TKIs耐药肺癌患者点亮新希望
中国生物制药CD3×CD20双抗癌症新药TQB2825再获批临床










































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论