导语
2024年ESMO大会T-DXd药物乳腺癌研究进展抢先看。
2024年欧洲肿瘤内科学会(ESMO)大会于9月13日至9月17日在西班牙巴塞罗那盛大召开,大会期间公布了众多重磅的前沿研究成果。抗体药物偶联物(ADC)是一类由高特异性单克隆抗体和高活性小分子细胞毒性药物组成的靶向治疗药物,其强大的抗肿瘤疗效有“魔法子弹”之称。德曲妥珠单抗(T-DXd)作为近年来备受瞩目的新型ADC药物,在乳腺癌领域取得重磅突破,本次大会中公布了多项研究进展。ADC Academy特筛选已发布摘要中T-DXd相关研究进行介绍,以飨读者。

Trastuzumab deruxtecan (T-DXd) in patients (pts) with HER2+ advanced/metastatic breast cancer (mBC) with or without brain metastases (BM): DESTINYBreast-12 primary results
德曲妥珠单抗(T-DXd)治疗伴或不伴脑转移(BM)HER2+晚期/转移性乳腺癌患者:DESTINYBreast-12研究的主要结果
研究全文同步发表于《Nature Medicine》,全文链接:https://doi.org/10.1038/s41591-024-03261-7。
▶ 背景:
T-DXd在HER2+转移性乳腺癌患者中的颅内活性之前已在小型或回顾性研究中观察到,这些患者具有稳定或活动性的(未经治疗/治疗中进展的)脑转移。这项IIIb/IV期、多中心、开放标签的研究是迄今为止针对这一患者群体进行的最大的前瞻性研究。
▶ 方法:
HER2+转移性乳腺癌成人患者,且在转移性环境中接受过≤2线治疗后病情进展,被纳入BM队列(包括稳定或活动性的脑转移[未治疗/治疗后进展],不需要立即进行局部治疗;允许使用地塞米松≤3毫克/日或等效药物控制症状)或非BM队列。研究设计不允许跨队列比较。患者接受T-DXd静脉注射,每3周一次,剂量为5.4mg/kg。主要研究终点是根据RECIST 1.1标准独立中央审查的基线伴BM组的无进展生存期(PFS)或基线不伴BM组的客观缓解率(ORR)。次要终点包括中枢神经系统(CNS)PFS、CNS ORR和ORR(基线伴BM组)以及安全性。间质性肺病(ILD)/肺炎由研究者报告,没有裁决委员会。
▶ 结果:
共纳入504例患者,其中263名属于BM组,241名属于非BM组。截至2024年2月8日,BM组的中位随访时间为15.4个月,非BM组的中位随访时间为16.1个月。患者人口统计学和基线特征如下。
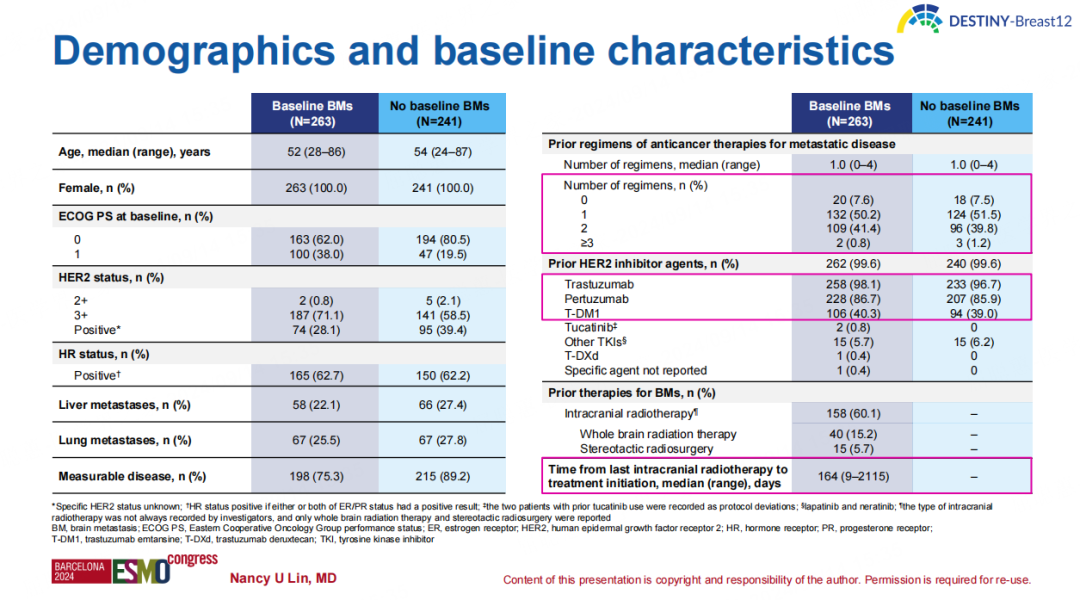

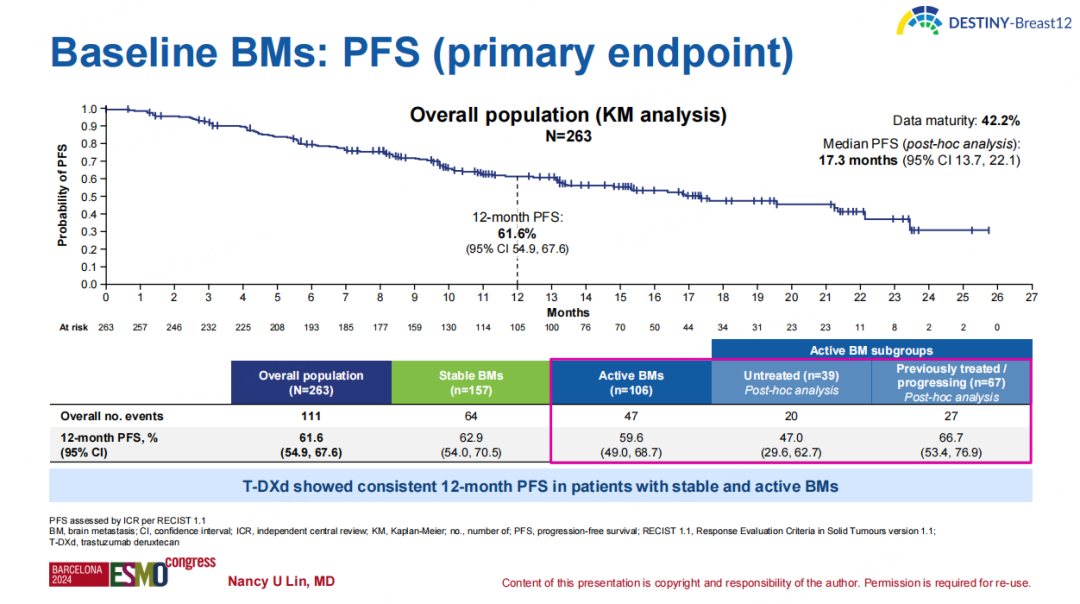
基线存在BM队列的中位PFS为17.3个月,12个月PFS率为61.6%(95%CI 54.9%-67.6%),稳定性和活动性BM患者的12个月PFS率分别为62.9%(95%CI 54.0%-70.5%)和59.6%(95%CI 49.0%-68.7%)。

基线存在BM队列12个月的CNS PFS率为58.9%(95%CI 51.9%-65.3%);在稳定性和活动性BM患者中,这一比例相似,分别为57.8%(95%CI 48.2%-66.1%)和60.1%(95%CI 49.2%-69.4%)。


基线存在BM队列的ORR为51.7%,基线可测量基本的患者的ORR达到64.1%。


基线时具有可测量的中枢神经系统疾病的BM患者中(n=138),确认的CNS ORR为71.7%(95%CI 64.2%-79.3%),在稳定性和活动性BM患者中CNS ORR分别为79.2%(95%CI 70.2%-88.3%)和62.3%(95%CI 50.1%-74.5%)。


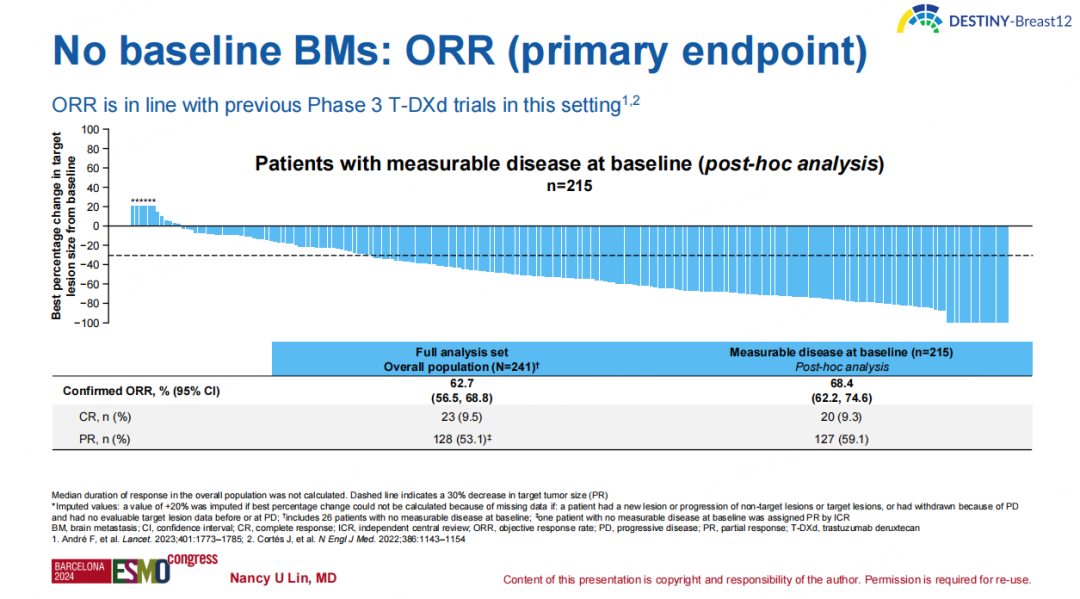
基线无BM队列总人群的ORR达到62.7%,基线时具有可测量疾病患者的ORR可达68.4%。

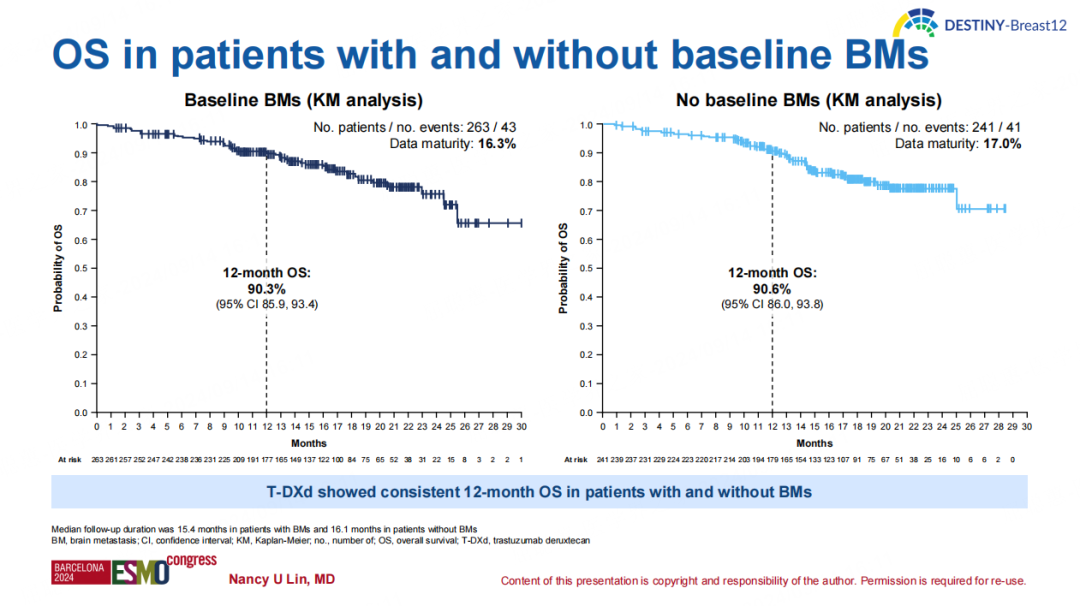
基线伴或不伴BM队列的12个月OS率分别为90.3%(95%CI 85.9-93.4)和90.6%(95%CI 86.0-93.8)。

安全性方面,T-DXd的安全性特征和既往研究报告一致,未出现新的安全性信号。间质性肺病或肺炎(ILD/p)仍然是T-DXd已识别的重要安全风险,观察到BM组和非BM组中有16.0%和12.9%的患者出现任何级别的ILD/p,且BM组中有少数患者出现了与机会性感染共发的ILD/p事件。
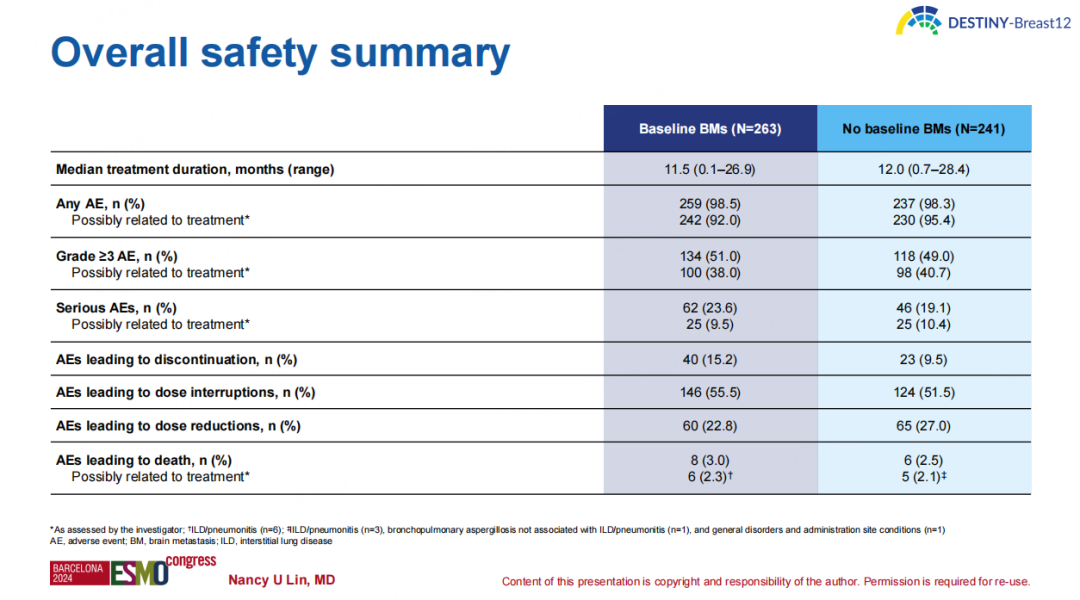
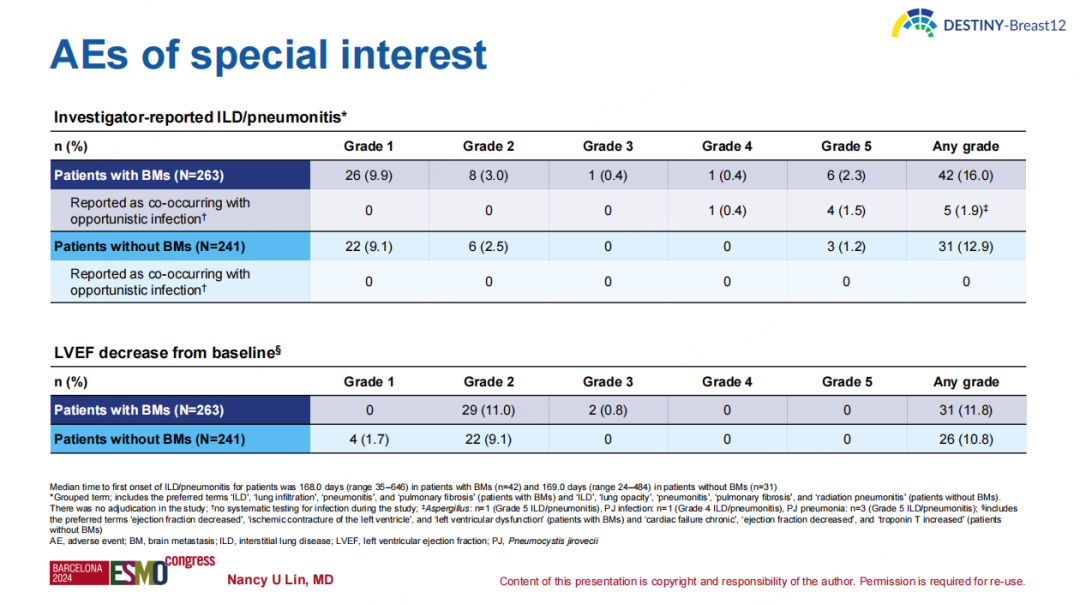


▶ 结论:
T-DXd在HER2阳性转移性乳腺癌患者中表现出显著且持久的整体和颅内临床活性,包括稳定性和活动性脑转移患者,且未出现新的安全信号。DESTINY-Breast12的结果支持无论是否存在稳定性或活动性BM都可以对HER2阳性转移性乳腺癌患者使用T-DXd。
Human epidermal growth factor receptor 2 (HER2)-low and HER2-ultralow status determination in tumors of patients (pts) with hormone receptor–positive (HR+) metastatic breast cancer (mBC) in DESTINY-Breast06 (DB-06)
DESTINY-Breast06(DB-06)研究中激素受体阳性转移性乳腺癌患者肿瘤中的人表皮生长因子受体2(HER2)低表达和HER2超低表达的测定
演讲时间:2024年9月15日08:40-08:45(当地时间)
Effects of trastuzumab deruxtecan (T-DXd) vs choice of chemotherapy (TPC) on patient-reported outcomes (PROs) in hormone receptor–positive, HER2-low or HER2-ultralow metastatic breast cancer (mBC): results from DESTINY-Breast06
德曲妥珠单抗(T-DXd)与医生选择的化疗(TPC)对HR阳性/HER2低表达或超低表达转移性乳腺癌患者报告结局(PROs)的影响:DESTINY-Breast06研究结果
演讲时间:2024年9月15日09:10-09:15(当地时间)
A multicentre, randomized, double-blind, placebo-controlled study of olanzapine-based triplet antiemetic therapy for prevention of delayed and persistent nausea and vomiting induced by trastuzumab deruxtecan in patients with metastatic breast cancer: ERICA study (WJOG14320B)
一项多中心、随机、双盲、安慰剂对照研究在转移性乳腺癌患者中评估以奥氮平为基础的三联止吐疗法在预防T-DXd引起的延迟性和持续性恶心呕吐中的应用:ERICA研究(WJOG14320B)
▶ 背景:
恶心/呕吐是T-DXd治疗相关的常见不良反应。研究评估了奥氮平在预防首次接受T-DXd治疗的患者出现恶心/呕吐的有效性。
▶ 方法:
ERICA研究是一项随机、双盲、安慰剂对照的II期临床研究。研究纳入计划接受T-DXd治疗的HER2阳性或HER2低表达的转移性乳腺癌患者,1:1随机分配至奥氮平5mg或安慰剂,每日一次,连续6天,与5-羟色胺3受体拮抗剂(5-HT3RA)和地塞米松(DEX:第1天静脉注射6.6mg或口服8mg)联合使用。观察期从首次T-DXd给药开始,持续504小时。研究的主要终点是延迟期(T-DXd给药后24-120小时)的完全缓解率(CR率;无呕吐事件且无需使用紧急救援药物),比较的显著性水平设定为0.2(单侧)。次要终点包括延迟期和持续期(120-504小时)的无恶心率,以及通过患者报告的不良事件评价标准(PRO-CTCAE)报告的症状和不良事件。
▶ 结果:
2021年11月至2023年9月,共入组日本43个研究中心的168名患者,其中162名患者(80名接受奥氮平治疗,82名接受安慰剂治疗)纳入符合方案集进行分析。研究达到了其主要终点,奥氮平组在延迟期的CR率显著高于安慰剂组(70.0% vs 56.1%,p=0.047;差异:13.9%,60%CI 6.9–20.7)。奥氮平组的无恶心率也显著高于安慰剂组(延迟期:57.5% vs 37.8%,p=0.009;差异:19.7%,95%CI 3.1–34.6;持续期:51.4% vs 31.9%,p=0.014;差异:19.4%,95%CI 2.9–35.1)。在延迟期,奥氮平组的CR率在各亚组中均优于安慰剂组。在首个治疗周期中,奥氮平组的患者恶心天数少于安慰剂组(4.0天 vs 8.0天,p=0.033)。接受奥氮平治疗的患者食欲减退的发生率低于接受安慰剂的患者(任何等级:60.0% vs 80.7%,p=0.006)。奥氮平组中观察到高血糖和嗜睡,大多数为低等级。


▶ 结论:
奥氮平5mg连续使用6天与5-HT3RA和DEX联合使用,可能是减少接受T-DXd治疗患者延迟和持续性恶心/呕吐的有效选择。
Unraveling the mechanisms of action and resistance to Trastuzumab deruxtecan (T-DXd): supplementary biomarker analyses from DAISY trial
揭示德曲妥珠单抗(T-DXd)的作用机制和耐药性:来自DAISY研究的补充生物标志物分析
▶ 背景:
T-DXd是一种抗HER2抗体药物偶联物,在HER2阳性及HER2低表达的转移性乳腺癌(mBC)患者中显示出临床意义的疗效。此外,在通过免疫组化(IHC)HER2评分为0的mBC患者中也观察到了抗肿瘤活性。本研究旨在探索DAISY研究中T-DXd的作用机制和耐药性。
▶ 方法:
DAISY是一项多中心、开放标签的II期研究(NCT04132960),评估了T-DXd在根据HER2表达水平分为三组的mBC患者中的疗效,并进行了生物标志物分析。疗效和生物标志物结果已于先前报告。为了进一步探索T-DXd的作用机制和耐药性,研究使用多重免疫组化对基线和治疗期间不同HER2表达水平的活组织切片进行了CD8+T淋巴细胞的颗粒酶B(GrB+)染色以评估其激活情况(n=24)。此外,使用RNAscope®评估了基线HER2 IHC评分为0的活组织切片(n=20)。最后,通过全外显子组测序探索了基线(n=92)和进展(n=30)时的活组织切片中的耐药性。
▶ 结果:
在C2D1或C3D1进行的组织活检中,使用T-DXd治疗期间GrB+/CD8+T淋巴细胞的密度没有显著增加(p=0.76)。未发现ERBB2 RNA表达的空间分布与T-DXd反应之间存在显著关联(p=0.39)。此外,在基线和进展时可分析的样本中,我们没有发现与耐药性相关的任何反复出现的驱动突变,也没有发现额外的SLX4突变。


▶ 结论:
T-DXd似乎不会在免疫肿瘤微环境中激活CD8+T淋巴细胞。此外,空间ERBB2表达在HER2不表达的mBC患者中并未成为T-DXd疗效的显著决定因素。未发现反复出现的驱动突变是导致耐药性的因素。
Trastuzumab Deruxctecan (T-DXd) associated interstitial lung disease (ILD) in a large real-world French cohort of patients with HER2-driven breast cancer and other malignancies
HER2驱动型乳腺癌和其他恶性肿瘤患者的大型真实世界法国队列中,德曲妥珠单抗(T-DXd)相关间质性肺病(ILD)的研究
▶ 背景:
T-DXd为HER2驱动的癌症提供了一种有前景的治疗方法,但伴随有显著的ILD风险。
▶ 方法:
2019年4月至2023年11月,对来自11个法国中心的600名患者进行了回顾性研究,通过集中CT扫描复审分析了ILD的临床和放射学数据。
▶ 结果:
在600名患者中,大多数为女性(95%),非吸烟者(77%),中位年龄为60岁。78%的患者之前接受过胸部放疗,54%接受过HER2靶向治疗。HER2驱动的乳腺癌占主导地位(93%),其中HER2高表达占54%,HER2低表达占39%,3.8%为肺癌患者。ILD发生在67名患者中(11.2%),中位发病时间为82天,常缺乏呼吸系统症状(51%)。尽管有55%的患者有肺转移,但在ILD发病时,80%的患者原发癌症得到了控制。放射学发现包括磨玻璃样密度(87%)和实变(61%)。组织性肺炎(OP)是主要的模式(52%),伴有不典型的卵圆形实变(25%)。在9%的病例中看到了弥漫性肺泡损伤(DAD)。ILD的严重程度主要为1-2级(81%)到3-4级(10%),其中9%(6/67)为致命性ILD,特别是4例伴有DAD模式。DAD模式的ILD发病时间更早,中位时间为51天。只有19名患者(全部为OP)进行了支气管肺泡灌洗,结果显示95%的患者有淋巴细胞性肺泡炎。50名患者停用了T-DXd(75%),其中60%接受了皮质类固醇治疗,60%的患者病情改善。与未发展为T-DXd-ILD的患者相比(6/533),发展为T-DXd-ILD的患者中既往有ILD病史(16/67,p<0.001)。


▶ 结论:
鉴于尽管原发癌症得到控制,T-DXd诱导的ILD仍具有潜在的严重性,因此早期检测和个体化管理对于T-DXd诱导的ILD至关重要。本研究强调了特定的放射学模式,其中DAD通常是致命的,强调了早期治疗策略的重要性。
Adverse effects (AEs) of trastuzumab deruxtecan (T-DXd) in solid tumours: A meta-analysis
T-DXd在实体瘤中的不良反应(AEs)的荟萃分析
▶ 背景:
T-DXd已被批准用于多种不同的实体瘤,本研究总结其安全性和耐受性概况。
▶ 方法:
从MEDLINE和ASCO、ESMO和SABCS大会中筛选符合条件的临床试验,纳入报告T-DXd的安全性和耐受性的I期剂量扩展、II期或III期临床研究。数据根据每项研究的样本量进行加权汇总,并通过样本大小加权的线性回归进行的回归分析探讨与AEs的关联。定量显著性定义为beta系数≥0.28。
▶ 结果:
纳入26项研究,共3853名患者,中位年龄57.5岁,80%为女性,57%为非白人种族。所有级别的AEs发生率为98.9%,≥3级AEs发生率为55.1%。最常见的不良反应包括恶心(69.2%)、疲劳(37.2%)、呕吐(36.2%)、贫血(35.8%)、脱发(32.6%)、腹泻(28.6%)和血小板减少(26.4%)。≥3级AEs中最常见的是贫血(12.3%)、血小板减少(7%)、疲劳(5.7%)和恶心(5.4%)。间质性肺病(ILD)发生率为13%,≥3级ILD为2.1%,中位发病时间为193天,1%的患者因ILD死亡。17.1%的患者因非疾病进展而停药,4.6%的患者因毒性而死亡。在双变量分析中,剂量与≥3级AEs和≥3级ILD之间的关联在调整性别、种族、地区和癌症部位后仍然显著。
不良事件关联的元回归分析的Beta系数
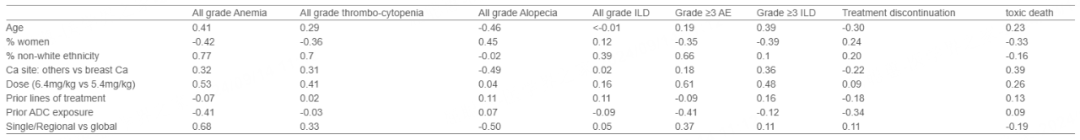


▶ 结论:
T-DXd的安全性和耐受性特征与细胞毒性化疗药物一致。AEs的风险在女性中较低,而在非白色人种和较高T-DXd剂量下较高。
Assessing Interstitial Lung Disease (ILD) Risk in Metastatic Breast Cancer (MBC): A Comprehensive Meta and Network Analysis of Antibody-Drug Conjugates (ADCs) compared to available treatment options beyond first line (1L)
评估转移性乳腺癌中的间质性肺病(ILD)风险:抗体药物偶联物(ADC)与一线后可用治疗方案比较的综合网状荟萃分析
▶ 背景:
ADC药物正成为所有转移性乳腺癌(MBC)亚型中的关键治疗选择,ILD是一种ADC药物治疗相关的不良事件。这项荟萃分析(MA)的目的是评估ADC引起的ILD风险与其他可用治疗选项相比,在一线治疗(1L)之后的MBC患者中的情况。
▶ 方法:
使用广义线性混合模型进行随机效应荟萃分析,对对数转换后的单个比例进行分析,以计算ILD的汇总比例。根据分子亚型和治疗类型进行亚组分析。还进行了网络荟萃分析(NMA),根据累积排名曲线下面积(SUCRA)对治疗进行排名。
▶ 结果:
共识别出38项研究,其中12项针对HER2+MBC,26项针对HER2-MBC,均大于1L。11项试验报告了ILD发生率,总体ILD风险为0.96%(95% CI 0.38-2.4)。包括的试验有BOLERO-3、DESTINY-Breast01、DESTINY-Breast02、DESTINY-Breast03、DESTINY-Breast04、TULIP、BOLERO-2、SOLAR-1、TROPION-Breast01、TROPiCS-02和EMBRACE。在分析的6,121名患者中,报告了214起ILD事件。与HER2-MBC患者相比,HER2+MBC患者的ILD风险更高(3.42%,95%CI 1.33-8.47;p=0.003)。此外,与内分泌治疗(ET)、化疗(CT)和靶向治疗(包括TKIs如拉帕替尼、尼拉替尼、图卡替尼和PARP抑制剂(PARPi))相比,接受ADCs(如T-DM1、T-DXd、T-Duo、SG和Dato-DXd)治疗的患者ILD风险更大(ADCs组发生率为5.55%,非ADC组为0.39%,95%CI 2.45-12.09;p<0.0001)。NMA显示,排名最低的ADC是T-DXd(SUCRA 0.2%),而排名最高的治疗是CT(SUCRA 85%)。
▶ 结论:
与接受ET、TKIs、PARPi和CT治疗的患者相比,接受ADCs治疗的患者ILD风险更高,包括含有依维莫司的方案。这些数据可能有助于治疗和监测决策的制定,特别是对于有呼吸风险因素的患者。
Treatment rechallenge after grade 1 trastuzumab-deruxtecan related interstitial lung disease: a real-world experience
发生1级德曲妥珠单抗相关间质性肺病后的再用药挑战:真实世界经验
▶ 背景:
德曲妥珠单抗(T-DXd)已获批用于治疗HER2阳性/HER2低表达的晚期乳腺癌、胃癌和非小细胞肺癌(NSCLC)。T-DXd存在罕见但可能严重的间质性肺病/肺炎(ILD;发生率12-15%)风险。对于有症状的ILD(≥G2级),T-DXd将永久停用。对于G1级ILD,T-DXd将暂停使用,并在ILD影像学上解决的情况下,存在再用药挑战(RC)。关于G1级ILD后T-DXd再用药挑战的数据有限。
▶ 方法:
纳入2018年至2023年期间接受T-DXd治疗的患者,通过病历审查确定了有ILD影像学证据的患者。T-DXd相关的ILD由治疗提供者评估,并通过CTCAE v5进行分级。
▶ 结果:
在176名接受T-DXd治疗的患者中,有29名(16%)发展为ILD(18-G1,7-G2,1-G3,1-G4,2-G5)。ILD的中位发病时间为首次剂量后131天。在有ILD的患者中,26名患有乳腺癌,3名患有胃肠道癌症,中位年龄为61岁,晚期疾病接受的中位治疗线数为3线;4/29名患者(14%)有肾功能损害(CrCl<60mL/min)。在G1级ILD患者中,14/18名(78%)接受了类固醇治疗,中位治疗时间为44天。接受类固醇治疗的患者在23天内观察到影像学改善,而未接受类固醇治疗的患者则为47天。18名G1级ILD患者中有14名(78%)进行了T-DXd的RC;4名患者疾病进展。两名未接受类固醇治疗的患者进行了RC。RC后,10名患者在没有复发ILD的情况下继续使用T-DXd,中位时间为100天;3名患者在数据锁定时(4/8/24)仍在使用T-DXd;4名患者在RC后中位148天(3-G1,1-G2)出现ILD复发。两名复发的G1级ILD患者进行了第二次RC(剂量减少),并在疾病进展前继续使用T-DXd(63天和211天)。为了评估ILD的影像学解决/改善情况,将报告正在进行的对所有CT扫描的盲法放射学审查数据。
▶ 结论:
本分析中T-DXd相关的ILD发生率与先前报告相似(所有级别16%,G5级1%)。大多数病例为G1级,接受类固醇治疗,并在ILD改善后进行了RC。RC后,患者平均继续使用T-DXd治疗100天。只有14名患者中的4名出现ILD复发,所有复发均为G1-2级,有2名患者进行了第二次RC。该队列提供了关于RC安全性和T-DXd最佳使用的重要临床信息;理解CT扫描的解决/改善是关键因素。
Exploratory Biomarker Analysis of Trastuzumab Deruxtecan Versus Treatment of Physician’s Choice in HER2-Low, Hormone Receptor–Positive Metastatic Breast Cancer in DESTINY-Breast04
DESTINY-Breast04研究中德曲妥珠单抗与医生选择的治疗在HER2低表达、激素受体阳性转移性乳腺癌中的探索性生物标志物分析
▶ 背景:
DESTINY-Breast04研究结果显示,在HER2低表达(IHC 1+或2+/ISH阴性)转移性乳腺癌患者中,德曲妥珠单抗(T-DXd)与医生选择的治疗方案(TPC)相比,无进展生存期(PFS)和总生存期(OS)有所改善。本研究展示了DESTINY-Breast04研究中在激素受体阳性患者中进行的探索性生物标志物分析结果。
▶ 方法:
对387名和315名患者的基线组织样本分别进行了转录组分析(通过RNA测序)和多标记免疫组化分析,以评估间质肿瘤浸润淋巴细胞(sTILs)。对414名患者的基线循环肿瘤DNA(ctDNA)样本使用Guardant OMNI进行了HER2激活突变分析,以及对235名患者的BRCA1/2突变和/或同源重组修复(HRR)基因改变进行了分析。研究了生物标志物状态与客观缓解率(ORR)或PFS之间的关系。
▶ 结果:
在HER2基因表达高于中位数的患者中,与低于中位数的患者相比,观察到T-DXd治疗组有改善ORR和PFS的趋势,以及HER2激活突变与无检测到的突变相比(未显示数据)。在BRCA1/2突变或HRR基因改变(未显示数据)的患者中,以及在两种治疗方案中,DNA损伤修复(DDR)/细胞增殖基因签名表达较高的患者中,观察到PFS缩短的趋势(未显示数据)。在两种治疗方案中,高sTIL水平(基于中位数的截止值)与PFS延长的趋势相关。一些亚组样本量较小是一个局限性。
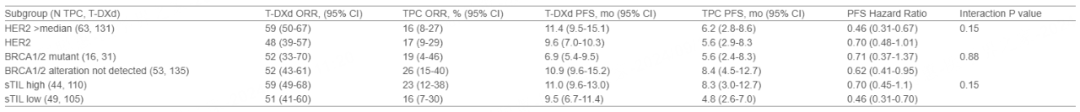
▶ 结论:
在所有分析的生物标志物亚组中,包括HER2基因表达水平、BRCA1/2或HRR基因改变状态、DDR/细胞增殖签名状态和免疫状态(sTILs),T-DXd治疗与TPC相比,在PFS和ORR方面显示出临床意义上的改善。
Safety and efficacy of trastuzumab deruxtecan and concomitant radiation therapy in patients with metastatic breast cancer: a multicentre international retrospective cohort study
德曲妥珠单抗联合放疗在转移性乳腺癌患者中的安全性和疗效:一项多中心国际回顾性队列研究
▶ 背景:
德曲妥珠单抗(T-DXd)已成为HER2+转移性乳腺癌患者在一线治疗(包含紫杉烷和曲妥珠单抗)疾病进展后的标准治疗。随后,DESTINY-Breast04的结果将T-DXd的获益人群扩展到HER2低表达患者。在转移性环境中,放射治疗(RT)通常需要用于姑息治疗或消融目的。研究旨在评估在连续的多中心国际乳腺癌患者队列中同时使用T-DXd和RT的安全性。
▶ 方法:
在三家领先的欧洲机构中对被诊断为HER2+或HER2低表达转移性乳腺癌患者进行了回顾性分析。患者在2021年5月至2024年3月期间开始接受T-DXd治疗,其中一些患者接受了伴随RT,而其他患者则没有。研究的主要目标是评估RT给药与2级(G)以上不良事件(AEs)之间的关联。
▶ 结果:
回顾性评估了99名连续患者的数据。32名患者在开始T-DXd治疗前(一个月内)或治疗期间接受了RT,共进行了33次伴随RT治疗,而67名患者没有接受。中位年龄为56岁。大多数患者(55.6%)将T-DXd作为系统治疗的第四线或更后线。中位总RT剂量处方为26 Gy,中位分割次数为5次。中位EQD2剂量为33 Gy,中位BED为39 Gy。最常治疗的部位是骨骼(43.8%的患者),其次是大脑(37.5%)。RT给药与G2+毒性发展的关系不显著(p=0.8)。在RT组中观察到一例2级间质性肺病(IDL),导致T-DXd停药(3.1%),而在无RT组中观察到三例(4.5%)。在12名接受颅内RT治疗的患者中未观察到放射性坏死事件。
▶ 结论:
研究的初步数据对于这种组合的潜在安全性是令人鼓舞的,显示伴随RT并未增加严重的急性毒性。
Trastuzumab deruxtecan with pyrotinib in first-line HER2-positive unresectable or metastatic breast cancer: an exploratory, multi-center, single-arm, phase II study (TROPHY, trial in progress)
德曲妥珠单抗联合吡咯替尼用于HER2阳性不可切除或转移性乳腺癌一线治疗:一项探索性、多中心、单臂、II期研究(TROPHY,试验正在进行中)
▶ 背景:
通过小分子酪氨酸激酶抑制剂(TKIs)和抗体药物偶联物(ADCs)靶向人类表皮生长因子受体2(HER2)已导致HER2阳性转移性乳腺癌患者的生存结果得到改善。德曲妥珠单抗(T-DXd)是一种HER2 ADC,在HER2阳性转移性乳腺癌的二线或更晚治疗中显示出显著的疗效(DESTINY-Breast03),并在全球许多国家获得批准。T-DXd一线治疗HER2阳性转移性乳腺癌的注册试验(DESTINY-Breast09)正在进行中。吡咯替尼,一种不可逆的泛HER受体TKI,也已在中国获得批准并在HER2阳性转移性乳腺癌患者中广泛使用。临床前和临床研究表明HER2 ADCs与TKIs联合使用具有协同效应。为了预期疗效的提高,正在进行多种HER2 ADCs和TKIs联合探索。因此,这项探索性II期TROPHY研究旨在评估T-DXd联合吡咯替尼用于中国HER2阳性转移性乳腺癌一线治疗的疗效和安全性。
▶ 试验设计:
对于在转移性环境中未接受过化疗或HER2靶向治疗,并且从新辅助或辅助治疗完成到晚期或转移性诊断的无病间隔期(DFI)>6个月后疾病进展的患者,将有资格进行登记。允许无症状或已治疗的脑转移。该研究包括两个主要部分。首先是剂量发现阶段,以确定推荐的II期剂量(RP2D),随后是剂量扩展阶段,从中国的8个地点开始,将有45名患者从RP2D开始入组。研究的主要终点是根据RECIST 1.1评估的无进展生存期(PFS)。次要终点包括根据RECIST 1.1评估的客观缓解率(ORR)和反应持续时间(DOR)、12个月和24个月的PFS和总生存率(OS)以及安全性。疗效和安全性将用描述性统计进行总结,而时间到事件终点将使用Kaplan-Meier方法进行分析。目前在中国的登记正在进行中。

ADC Academy Online
ADC Academy Online是聚焦于抗体偶联药物的学术交流平台。平台紧跟相关领域的最新进展,致力于促进相关专业人士的科学交流和继续医学教育。



































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论