1
前言
过去十年中,免疫检查点抑制剂(ICI)和嵌合抗原受体(CAR)-T细胞在癌症治疗中取得了巨大成功,在一小部分癌症患者中导致肿瘤完全消退和持久缓解,然而大部分患者对这些免疫疗法没有反应或反应有限。这些肿瘤具有“冷”肿瘤的特征,即低密度的肿瘤浸润淋巴细胞和高度免疫抑制的微环境。全球制药公司一直在探索各种策略,以克服免疫疗法对这种“冷”肿瘤的有限疗效。
2015年,美国食品和药物管理局(FDA)和欧洲药品管理局(EMA)批准了溶瘤病毒Imlygic。Imlygic的临床前和临床数据表明OVs可以改变“冷”肿瘤的免疫微环境,以改善各种免疫治疗药物的整体抗肿瘤免疫应答。OVs具有若干独特的特征,其通过级联感染和随后的肿瘤细胞裂解选择性地在癌细胞中繁殖,并且导致肿瘤裂解物、病原体相关分子模式(PAMP)、损伤相关分子模式和肿瘤相关抗原(TAA)的产生,并增加各种细胞因子和趋化因子的产生。溶瘤过程的这些副产物可增强抗肿瘤免疫(先天性和适应性)反应的各个方面。此外,OVs可以导致远处转移瘤的消退,并建立肿瘤特异性免疫记忆。
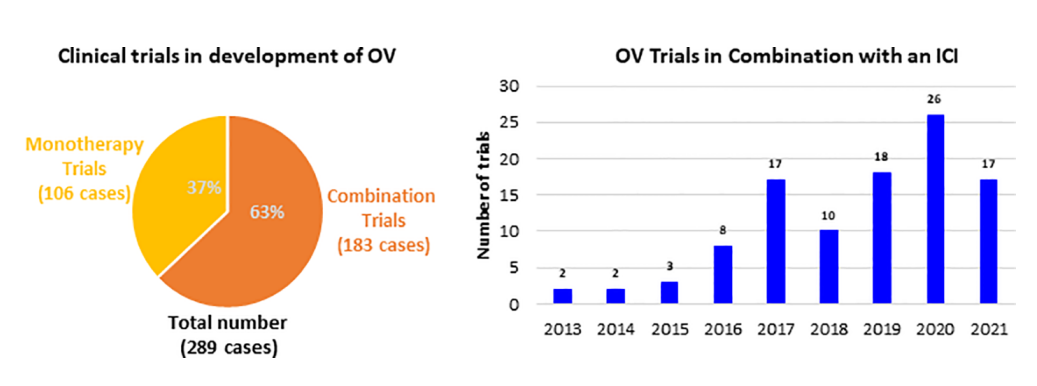
OVs的这些免疫特性增强了其治疗优势。目前,OV的治疗策略正在临床中得到广泛开发,从单一疗法到与其他癌症疗法的组合。这些试验在过去8年中不断增长,许多初步数据显示了OVs良好的治疗前景,其在未来将成为癌症免疫治疗的重要组成部分。
2
溶瘤病毒发展史
实际上,用活的嗜瘤病毒治疗癌症有着悠久的历史。自19世纪中期以来就有病例报告表明癌症患者的自然微生物感染有时可以暂时减轻肿瘤负担,这引起了研究人员的好奇,随后便诞生了溶瘤病毒的概念及相关研究。
从1949年开始,人们使用不同类型的野生型非减毒病毒进行了许多临床试验。此后不久,OV领域的趋势演变为开发对人类致病性较小的基因修饰病毒,如减毒活疫苗。在过去的20-30年中,这一转变一直延续到使用转基因病毒进行癌症治疗的时代,包括利用病毒基因敲除和/或治疗性转基因敲入。
进入21世纪,在许多临床试验得到积极结果之后,OV领域获得了相当大的关注。到目前为止,已经在全球批准了四项OV药物。

第一种OV是一种被称为Rigvir的小核糖核酸病毒,在拉脱维亚被批准用于治疗黑色素瘤,但未得到广泛应用。其次,2005年中国批准了一种名为H101的工程腺病毒,用于治疗头颈癌。第三,2015年,美国和欧洲批准了另一种名为Talimogene Laherparepvec(T-VEC)的工程单纯疱疹病毒(HSV-1)OV,用于治疗不可切除的转移性黑色素瘤。最后,在2021年,日本批准了一种改良的单纯疱疹病毒,名为DELYTACT,用于治疗胶质母细胞瘤等脑癌。
3
溶瘤腺病毒的临床概况
腺病毒是临床试验中最早研究的基因治疗载体之一,其临床安全性已被广泛评估和记录。Oncorine是2005年在中国批准临床使用的第一个OV,其被认为是溶瘤腺病毒(oAd)在临床应用的良好证明。oAd的主要优势在于其诱导强烈抗肿瘤免疫反应、抗血管生成作用、高转基因表达以及与其它治疗联合的协同抗癌作用。因此,oAd是临床试验中最常用的OV,约占所有试验的42%。
目前,oAd的全身递送仍然是一个主要挑战,试验大多集中在最大化诱导oAd介导的全身抗肿瘤免疫应答的策略。许多正在进行或正在招募的I期试验(NCT01437280、NCT02143804和NCT02365818)正在评估表达促炎细胞因子(GM-CSF、IL-2、IL-12)或共刺激因子(4-1BBL或CD40L)的oAd。
Ad5-yCD/mutTKSR39rep-hIL12是一种表达人IL-12基因和两种自杀基因,酵母胞嘧啶脱氨酶(yCD)和HSV胸苷激酶(TK)的oAd。Ad5-yCD/mutTKSR39rep-hIL12表达的自杀基因均成功转化为各自的前药,诱导DNA合成的不可逆抑制,并产生有效的抗肿瘤作用。此外,Ad5-yCD/mutTKSR39rep-hIL12通过表达hIL-12改善了抗肿瘤免疫应答的诱导。基于这些发现,目前启动了两个一期临床试验(NCT02555397和NCT03281382),分别评估其治疗前列腺癌或转移性胰腺癌患者的疗效和安全性。
表达GM-CSF的oAd有两项临床试验正在进行中,ONCOS-102和CG0070。由Targovax开发的ONCOS-102在1期临床试验中显示出令人鼓舞的结果,在40%的可评估病例中显示病情稳定。目前,正在研究一项联合ONCOS-102和Keytruda的临床试验(NCT03003676)。另一种表达GM-CSF的oAd-CG0070,最近在一项针对卡介苗无反应的高度非肌肉浸润性膀胱癌的II期研究中
(NCT02365818)获得成功。结果显示,CR率为23%(3/13),此外接受多次注射的患者CR应答率大大提高,达到64%(14/22)。目前,CG0700单药治疗的III期研究正在进行中(NCT04452591),以及CG0070与Keytruda联合治疗卡介苗无反应性NMIBC患者的II期临床试验(NCT04387461)。
4
溶瘤性单纯疱疹病毒的临床概况
溶瘤性单纯疱疹病毒(oHSV)与其他几种类型的OV一样,可以直接杀死肿瘤细胞并促进抗肿瘤免疫反应。此外, HSV是为数不多的具有良好抗病毒药物的病毒之一,这些属性使oHSV在临床上更具安全性,因为临床医生可以有效地管理与病毒相关的不良事件。此外,oHSV还具有较大的基因组大小和相对较大的转基因插入能力。
Talimogene laherparepvec是一种表达GM-CSF的oHSV,也称为Imlygic,是FDA和EMA批准的第一种溶瘤病毒,在黑色素瘤患者中显示出良好的抗肿瘤活性。除了Imlygic已获批,其他几个oHSV正在进行临床研究中。此外,在临床试验中,越来越多的oHSV携带IL-12作为转基因,如M032治疗复发性恶性胶质瘤的两个I期临床试验(NCT02062827和NCT02062 827);C5252和MVR-T3011这两个oHSV都在与PD-1抗体的联合测试中(NCT04370587、NCT04780217和NCT05095441);VG161共表达IL-12、IL-15和PD-L1阻断肽在3个I期或I/II期试验中进行评估。
5
溶瘤痘苗病毒的临床概况
痘苗病毒(VV)是一种带有线性双链DNA病毒的膜包衣病毒,已证明能有效感染、复制并杀死多种癌细胞。此外, VV还具有确保良好安全性的属性:VV复制周期发生在细胞质中,因此没有基因组整合的风险,而且迄今为止没有相关的人类疾病报告。然而,VV的一个主要缺点是50%的VV基因具有未知功能,这可能导致与其他癌症治疗药物相互作用时产生不可预见的副作用。
临床试验中测试最广泛的oVV是表达人GM-CSF的Pexa Vec(pexastimogene devacirepvec,也称为JX-594)。Pexa Vec在难治性实体瘤患者中耐受性良好,显示出良好的安全性(NCT01169584)。重要的是,Pexa Vec与索拉非尼联合的II期临床试验(NCT00554372)显示,可提高肝癌患者的长期生存率(高剂量组和低剂量组分别为35%和11%)。然而遗憾的是,Pexa Vec与索拉非尼联合治疗肝癌的III期试验(NCT02562755)结果中,未能改善患者在标准护理方面的临床结果。
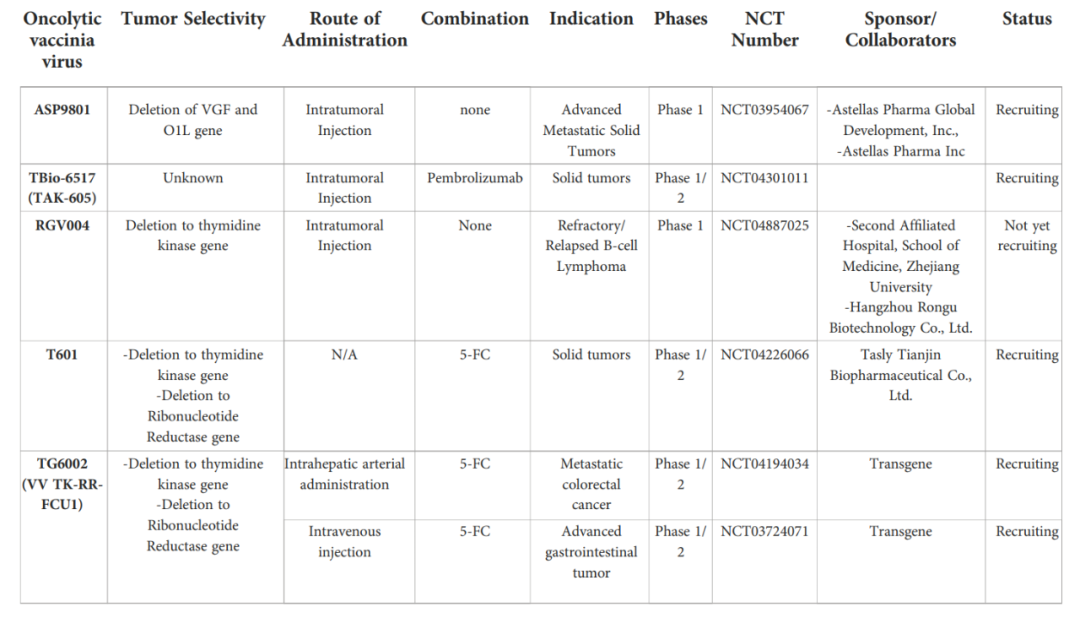
尽管Pexa Vec的III期试验结果令人失望,但在针对多种肿瘤类型的临床试验中,还有其他几种oVV可能产生有希望的结果。例如,2015年,JX-929的I期试验结果显示了良好的安全性和肿瘤特异性。在高剂量组中,3例病毒复制活跃的患者中,有2例在注射病灶中观察到抗肿瘤活性和肿瘤消退。JX-929的另一个I期试验(NCT00574977)也显示了良好的安全性。
6
其它OV的临床概况
虽然oAd、oHSV和oVV是临床中最广泛评估的OV,但还有其他类型的病毒,如呼肠孤病毒、麻疹病毒(MV)以及小核糖核酸病毒,目前正在临床中进行评估。
呼肠孤溶瘤病毒
Pelareorep是一种哺乳动物正呼肠孤病毒3型Dearing毒株,是临床试验中评估最广泛的OV之一。Pelareorep是一种无包膜双链RNA病毒,已知在成人中相对无致病性。
Pelareorep的第一项人体I期研究,REO-001,纳入了19名晚期实体瘤患者。试验未观察到剂量限制性毒性,大多数治疗相关不良反应为二级或以下,37%的患者观察到肿瘤反应。随后的研究表明,患者对静脉给药的病毒耐受性良好,但仅产生了适度的治疗效益。
由于在多个临床试验中,Pelareorep作为单一疗法的疗效不一致且不足,因此启动了一系列II期试验,以评估静脉给药的pelareorep与不同类型癌症的标准治疗的联合效果。然而不幸的是,这些试验中的大多数(4/6)表明,与单纯化疗相比,Pelareorep联合标准化疗未能改善无进展生存期;此外与化疗组相比,Pelareorep联合用药组严重不良事件风险(3级或4级)增加。
目前,Pelareorep的最新临床开发集中于免疫刺激方面,与ICIs(NCT04102618、NCT04215146、NCT04445844、NCT03723915、NCT03605719)或GM-CSF(NCT02444546)联合应用。最近的两项临床研究表明,这种将Pelareorep与其他癌症免疫疗法相结合的策略可能产生有希望的结果。
溶瘤性麻疹病毒(MV)
MV是一种包膜RNA病毒,在淋巴瘤患者中具有长期的抗肿瘤活性。最近发表的临床研究利用表达人癌胚抗原(CEA;MV-CEA)可溶性细胞外结构域或人甲状腺碘化钠转运体(NIS;MV-NIS)的oMV来监测体内病毒基因的实时表达。
目前,大多数正在进行的临床试验使用MV-NIS构建体而不是MV-CEA,这可能是由于NIS具有更大的临床适用性,因为MV-NIS可以增强肿瘤病变处治疗性放射性同位素的累积,并在临床前模型中诱导额外的抗肿瘤作用。一项评估晚期多发性骨髓瘤的I/II期试验(NCT00450814)表明, MV-NIS单药治疗耐受性良好,未观察到剂量限制毒性。在疗效方面,有一名患者实现了持久的完全应答,32名患者中有4名患者观察到血清游离轻链水平(MM的生物标志物)降低了25%以上。目前,一些I期或II期临床试验正在进行或正在招募人员,以评估多种癌症类型中的MV-NIS(NCT02364713、NCT01846091、NCT02962167、NCT02700230和NCT03171493)。
小RNA溶瘤病毒
目前,两种不同的小RNA溶瘤病毒,即lerapolturev(先前称为PVSRIPO)和V937(之前称为CAVATAK和CVA21)正在积极的临床开发中。另一种溶瘤性小RNA病毒NTX-010,迄今为止已进行了一项I期试验和II期试验(分别为NCT01048892和NCT01017601),但由于未能提高总体生存率或无进展生存率,该试验提前终止,且未进行后续临床开发。
Lerapolturev在PD-1难治性黑色素瘤患者的一期临床试验结果显示,在33%的患者(4/12)中产生了客观响应,这些患者在病毒给药10天后观察到肿瘤消退。两名患者在注射和非注射病灶中均显示病理学完全反应,注射部位的治疗后活检样本显示大量巨噬细胞聚集。值得注意的是,在12名患者中,6名患者在接受lerapolturev治疗后恢复ICI治疗,疾病得到了持久控制,并且在18个月的中位随访期内保持无进展,这表明PD-1难治性肿瘤可能对PD-1阻断剂再敏感。基于这一有希望的结果,目前正在进行一项多中心II期试验(NCT04577807)。
V937是一种野生型柯萨奇病毒A21,是另一种正在积极临床开发中的小RNA溶瘤病毒。最近公布的两项I期和II期研究结果表明,在非肌肉浸润性膀胱癌(NCT02316171)或不可切除黑色素瘤(NCT01227551和NCT01636882)患者局部(膀胱内或肿瘤内)病毒注射的耐受性良好,未观察到2级或更高级别的病毒相关不良事件。就疗效而言,V937膀胱内给药导致肿瘤表面出血和炎症增加,一期试验(NCT02316171)入选的15名NMIBC患者中有1例肿瘤完全消退。此外,V937在57名无法切除的黑色素瘤患者中进行的II期临床试验也产生了有希望的治疗结果,12个月的PFS为32.9%,持久应答率为21.1%,最终12个月的总生存率为75.4%(NCT01227551和NCT01636882)。
小结
参考文献:
公众号内回复“肿瘤免疫”或扫描下方图片中的二维码免费下载《小药说药肿瘤免疫全集》的PDF格式电子书!

公众号已建立“小药说药专业交流群”微信行业交流群以及读者交流群,扫描下方小编二维码加入,入行业群请主动告知姓名、工作单位和职务。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论