丹麦哥本哈根本地时间2024年11月4日,Ascendis Pharma A/S(NASDAQ:ASND,下称Ascendis)宣布已授予诺和诺德TransCon技术平台的全球独家许可,以开发、制造和商业化诺和诺德在代谢性疾病(包括肥胖和2型糖尿病)方面的专有产品,并授予其在心血管疾病方面的产品独家许可。
根据协议,Ascendis将有资格获得高达2.85亿美元的预付款、开发和监管里程碑付款。此外,公司还将有资格获得基于销售额的里程碑付款和全球净销售额的分层特许权使用费,对于每一个额外的代谢或心血管疾病候选产品,Ascendis将有资格获得高达7750万美元的开发和监管里程碑付款,以及基于销售的里程碑付款和全球净销售额的分层特许权使用费。Ascendis将在合作下对TransCon候选产品进行早期开发。诺和诺德将负责这些早期开发成本以及临床开发、监管、商业制造和商业化。
该协议包括要求某些基于TransCon技术的产品在代谢疾病中得到识别和改进的条款,以保持该领域的排他性,以及针对心血管疾病的额外条款。根据协议条款,诺和诺德还获得将任何由此产生的代谢性疾病产品扩展到其他治疗领域的独家权利。该合作的主要项目是每月一次的GLP-1受体激动剂候选产品,最初将针对肥胖和2型糖尿病。
TransCon技术平台,定制化的“暂时连接”
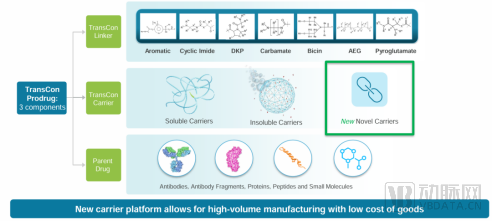
Ascendis目前的核心资产正是TransCon技术平台。TransCon是指“暂时连接”(Transient Conjugation)。TransCon分子包括3个部分:未经修饰的原型药物(Parent Drug),保护原型药物的惰性载体分子(TransCon Carriers)和将两者暂时连接起来的连接结构(TransCon Linkers)。当3个部分结合后,载体分子可以使得原型药物以失活状态存在,并且不被人体清除。当注射至人体内后,在生理条件的pH和体温下,有活性的、未经修饰的原型药物将以可控的方式释放出来。由于原型药物是未经修饰的,因此可以维持其原有的作用机制。
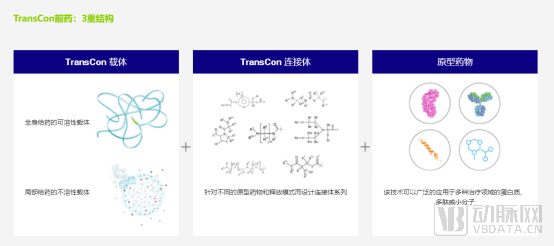
这其中的关键技术壁垒在于,传统的前药需要在体内经酶或非酶的转化释放出有活性药物而发挥药效,而不同的病人之间,甚至同一个病人不同组织之间,转换率不同,个体差异很大,无法预测前药在体内的转换率。
TransCon载体分为系统性载体和局部载体,这些载体通常为PEG或者一些天然或者合成的多聚合物。公司的三款候选药物TransCon hGH、 TransCon PTH和TransCon CNP载体均为PEG的。局部的载体可以使药物在局部高浓度的释放,从而增加药物的治疗窗口。
总体而言,TransCon技术平台就是一个可针对不同的母药,设计定制与其连接的Linker的平台,将其改进为每周一次、每月一次、甚至半年一次应用的长效制剂。
临床进展积极,候选产品尚待商业化
2018年,Ascendis Pharma和维梧资本、Sofinnova Ventures决定在上海创立维昇药业,前者以产品入股,维梧资本和Sofinnova Ventures出资支持,并给予了三款内分泌候选产品的全权研发及商业化权利。公司拥有50%的股权,其他有维梧资本及Sofinnova Ventures持有维昇药业部分股权。
根据维昇药业与Ascendis的达成独家许可协议,公司能够在相关地区开发、生产和商业化隆培促生长素(lonapegsomatropin)、那韦培肽(navepegritide)及帕罗培特立帕肽(palopegteriparatide)等内分泌领域的候选药物。
其中,隆培促生长素是一款每周一次的长效生长激素替代疗法,用于治疗儿童生长激素缺乏症(PGHD,一种生长激素不足导致的18岁以下患者中常见的矮小症)。隆培促生长素已在中国完成3期关键性试验,数据显示针对国内生长激素缺乏症的儿童52周的治疗后,其年化生长速率(AHV)达到10.66厘米,在统计学意义上显著优效于对照组生长激素日制剂(AHV=9.75厘米)。
此外,隆培促生长素BLA已于2024年1月18日提交,随后于2024年3月7日获国家药监局受理,这也标志着维昇药业首款新药的商业化之旅即将开启。
在生长激素这条市场潜力超百亿的赛道,国内市场已近十年都没有任何创新长效产品上市。而且,隆培促生长素通过其3期临床结果证实,它是截至目前唯一优效于生长激素日制剂的长效生长激素。值得一提的是,在全球既往的长效生长激素竞赛中,曾有12个公司在这个指征的研发中以失败告终,而Ascendis的长效生长激素隆培促生长素有望成为儿童GHD的一线首选治疗药物。
与此同时,另外两个核心产品也分别取得了积极临床结果。
那韦培肽,是一款C型利钠肽的长效前药,用于治疗软骨发育不全(一种短肢型矮小症,可导致严重的骨骼并发症及合并症)。那韦培肽在中国已经完成用于治疗软骨发育不全的2期临床试验的双盲期试验,并于2024年4月完成该项试验开放标签阶段最后一位患者的最后一次访视。
帕罗培特立帕肽是一款每日一次的甲状旁腺激素替代疗法,用于治疗慢性甲状旁腺功能减退症(一种由甲状旁腺激素分泌减少或功能缺陷所引起的钙磷代谢异常综合症)。帕罗培特立帕肽目前正在中国进行一项3期关键性试验的开发;其已于2023年1月完成双盲期试验,且预计将于2025年上半年向国家药监局提交NDA。
维昇药业近日向港交所递交了招股书,拟在香港主板挂牌上市。值得注意的是,这是继其于2022年11月17日、2023年8月16日、2024年3月21日先后三次递表失效后的再一次申请。据招股书显示,尽管公司在研候选药物的所有知识产权均由Ascendis授予独家许可,不过从2022年算起,维昇药业还是在研发上2年累计投入超过2.3亿元。
在百亿市场抢跑
基于TransCon技术平台的积极临床信息,也被诺和诺德看在眼里。
在长效生长激素领域,全球共有4款长效生长激素获批上市。除了金赛药业的金赛增外,其余均为海外药企产品,分别是诺和诺德的Sogroya、Ascendis的Skytrofa和辉瑞的Ngenla。其中Sogroya是美国FDA批准的首个长效生长激素制剂,用于治疗2.5岁及以上因内源性生长激素分泌不足而出现生长障碍的儿童患者,以及生长激素缺乏症成人内源性生长激素的替代治疗。目前已在多个国家和地区批准上市。
依照诺和诺德2024半年报中披露的战略布局看,罕见病也是其布局中的四大支柱之一,不过,公司的核心产品仍然以糖尿病和肥胖症药物为代表。2023年美国糖尿病协会(ADA)、欧洲糖尿病协会(EASD)发布的最新指南已将GLP-1 列为2型糖尿病的一线用药。诺和诺德2023年年报显示,GLP-1药物司美格鲁肽整体销售收入1458.11亿丹麦克朗,约合212亿美元,而仅司美格鲁肽的减重适应证销售额暴涨406%,达到313.43亿丹麦克朗,约合46亿美元。
GLP-1的发展也经历了从短效到长效再到超长效的发展历程。
当前,给药方式的局限性、潜在的免疫原性以及细胞膜渗透性差等是多肽及蛋白质大分子药物面临的共性问题,而GLP-1激动剂的最大的挑战来自于过短的半衰期。人体分泌的GLP-1半衰期仅为1-2min,分泌到血液循环后易被二肽基肽酶4(DPP-4)快速降解而失去促胰岛素分泌的活性。因此,不断更新长效机制(注射、口服)以提升半衰期,成为GLP-1激动剂研发亟待攻克的技术难点及推动产品更新迭代的内在动力。
而在口服机制发力的MNC并非一帆风顺。2023年12月,辉瑞放弃第二代口服GLP-1RA药物Danuglipron,原因是观察到不良反应发生频率较高。2023年6月,辉瑞决定放弃GLP-1小分子Lotiglipron的继续开发,核心原因在于其安全性问题遭遇了巨大的挑战。在临床二期试验中,入组受试者的转氨酶(肝功能受损)升高的测量结果,很可能是由于人体内小分子GLP-1药物的代谢主要由肝脏内相关蛋白质活动处理,从而导致肝脏负担增加。
而作为在2型糖尿革命性治疗领域优先抢占绝对优势的诺和诺德,显然不会错过进一步攻克长效机制痛点的机会。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论