中国香港、上海和美国新泽西州: 2024年7月31日,星期三: 和黄医药 (中国) 有限公司 (简称 "和黄医药" 、 "HUTCHMED" 、 "本公司" 或 "我们") (纳斯达克/ 伦敦证交所: HCM; 香港交易所: 13) 今日公布截至2024年6月30日止六个月的财务业绩以及提供关键临床项目和商业化发展的最新进展。
除另有说明外,所有金额均以美元列示。
收入增长势头持续,现金结余充裕支持扩展
重申2024年全年肿瘤/免疫业务综合收入财务指引为3亿至4亿美元,其中2024年上半年为1.687亿美元,得益于59% (按固定汇率[1]计算为64%) 的肿瘤产品收入增长。 FRUZAQLA® 2024年上半年美国市场销售额[2]为1.305亿美元‒ 显示自2023年11月上市以来,强劲的市场需求和商业吸引力。 2024年上半年净收益为2,580万美元。截至2024年6月30日现金余额为8.025亿美元,得益于我们持续提升关键研发[3]项目的优先级并提高商业效率。
呋喹替尼全球布局持续推进,管线进一步拓宽并取得切实进展
FRUZAQLA®于2024年6月获欧盟委员会批准后,正在合作伙伴武田[4]的带领下为其在欧盟上市做准备 ‒ 在FRESCO-2研究的支持下,已在十几个国家和地区提交上市许可申请。
和黄医药正为索乐匹尼布在中国上市做准备,用于治疗免疫性血小板减少症[5] ‒ 有望成为公司首款血液学药物,其新药上市申请[6]已于2024年1月获受理并获纳入优先审评。
基于SAVANNAH研究数据,有望于年底在美国提交赛沃替尼用于治疗非小细胞肺癌[7]的新药上市申请。
旨在在中国扩展沃瑞沙®和爱优特®的使用范围和达唯珂®的新药或新适应症上市申请已获受理— 分别用于治疗MET外显子14跳变[8]的非小细胞肺癌初治患者、子宫内膜癌患者和滤泡性淋巴瘤患者。
15项关键后期注册试验已启动,目前正在进行/正在审评中‒ 涉及六种候选药物:索乐匹尼布用于治疗温抗体型自身免疫性溶血性贫血[9]的ESLIM-02研究, HMPL-306用于治疗急性髓系白血病[10]的RAPHAEL研究,以及索凡替尼用于治疗胰腺导管腺癌[11]的研究。
持续壮大的血液学产品组合,在现有靶向Syk[12]、EZH2[13]、IDH[14]、BTK[15]和CD47的抑制剂和抗体产品组合的基础上,新加入了靶向Menin和CD38的项目。
和黄医药非执行主席
艾乐德(Dan Eldar)博士表示:
和黄医药在今年上半年表现强劲。团队继续实施我们的战略并取得了重要的进展,持续发现和开发创新及有效的药物;在中国本土市场和全球市场开展临床试验;及快速实现监管注册和商业目标。我很高兴看到我们与武田的合作继续取得成功,也很高兴看到公司为海外患者带来医疗获益的能力不断增强。在此期间,我们在美国的收入持续增长,预计未来数月还将迎来在更多其他国家的收入增长。我们还会充分发挥我们在中国将新药带向市场,以及为已上市药物扩展新适应症的良好经验,期望在未来几年取得多项潜在新药上市申请批准。
我想借此机会向刚刚退休的杜志强先生表示衷心感谢,杜先生见证了和黄医药的创立,并作出了重大贡献,令和黄医药成长为一家全球性的创新型生物医药公司,致力于发现、开发和商业化癌症和免疫性疾病疗法,以改善全球患者的生活质量。我期待着带领公司迈入充满潜力与希望的新发展阶段。
最新业务进展
和黄医药首席执行官兼首席科学官
苏慰国博士表示:
和黄医药团队始终不懈努力,以保持我们近年来在临床及监管注册方面的良好势头,并推动已获批产品取得商业上的成功。我要感谢每个人的辛勤工作及投入。与2023年上半年相比,我们的肿瘤产品收入增长了59%,与此同时,我们在推进研发管线时也更具侧重性,拥有巨大潜力创造更高价值。我们在今年新启动了三项关键性的后期研究,管线中目前共有十多项关键性研究正在进行中,有望在未来支持更多药物审批。
我们为实现药物全球化而采取的合作战略,帮助我们在为内部研发引擎提供持续的动力,以及推动本土市场销售的同时,将我们的创新药物带向全球更多地区的患者。FRUZAQLA®在武田带领下的初步销售表现令人赞赏,证明了我们药物的品质及其在全球市场的潜力,以及验证了我们在海外市场采取合作战略的成效。
下半年我们将继续推进各项注册研究。我们期待在年底左右在中国取得索乐匹尼布的注册批准,并在美国提交赛沃替尼的新药上市申请。我们将继续朝着成为一家可持续发展的生物医药企业这一目标迈进。
一. 商业营运
肿瘤业务市场销售额增长140% (按固定汇率计算为145%) 至2.433亿美元 (2023年上半年:1.013亿美元),得益于此,肿瘤产品综合收入强劲增长59% (按固定汇率计算为64%) 至1.278亿美元 (2023年上半年:8,010万美元),主要包括以下重点:
FRUZAQLA®(呋喹替尼的海外商品名) 于2023年11月在美国上市,市场销售额为1.305亿美元 (2023年上半年:无)。其强劲的业绩得益于在美国市场获患者快速接纳,以及销售渠道库存需求的拉动;
爱优特® (ELUNATE®,呋喹替尼的中国商品名) 市场销售额增长8% (按固定汇率计算为13%) 至6,100万美元 (2023年上半年:5,630万美元),与结直肠癌[16]市场的增速一致,我们的市场份额在市场竞争加剧的情况下依然保持领先;
苏泰达® (SULANDA®,索凡替尼) 市场销售额增长了12% (按固定汇率计算为17%) 至2,540万美元 (2023年上半年:2,260万美元),得益于医生对该产品的认知度持续提升,令对神经内分泌瘤患者的可及性及市场份额提高;及
沃瑞沙® (ORPATHYS®,赛沃替尼) 市场销售额增长了18% (按固定汇率计算为22%) 至2,590万美元 (2023年上半年:2,200万美元),得益于非小细胞肺癌患者中MET外显子14跳变检测及诊断的进步,以及在纳入国家医保药品目录[17]后第二年持续的增长势头。
来自武田的首付款、里程碑及研发服务收入3,380万美元 (2023年上半年:2.691亿美元),其中包括从4.35亿美元的首付款和里程碑付款中确认的1,940万美元,该款项已于2023年以现金形式从武田收到。相比之下,去年同期确认的款项为2.587亿美元。
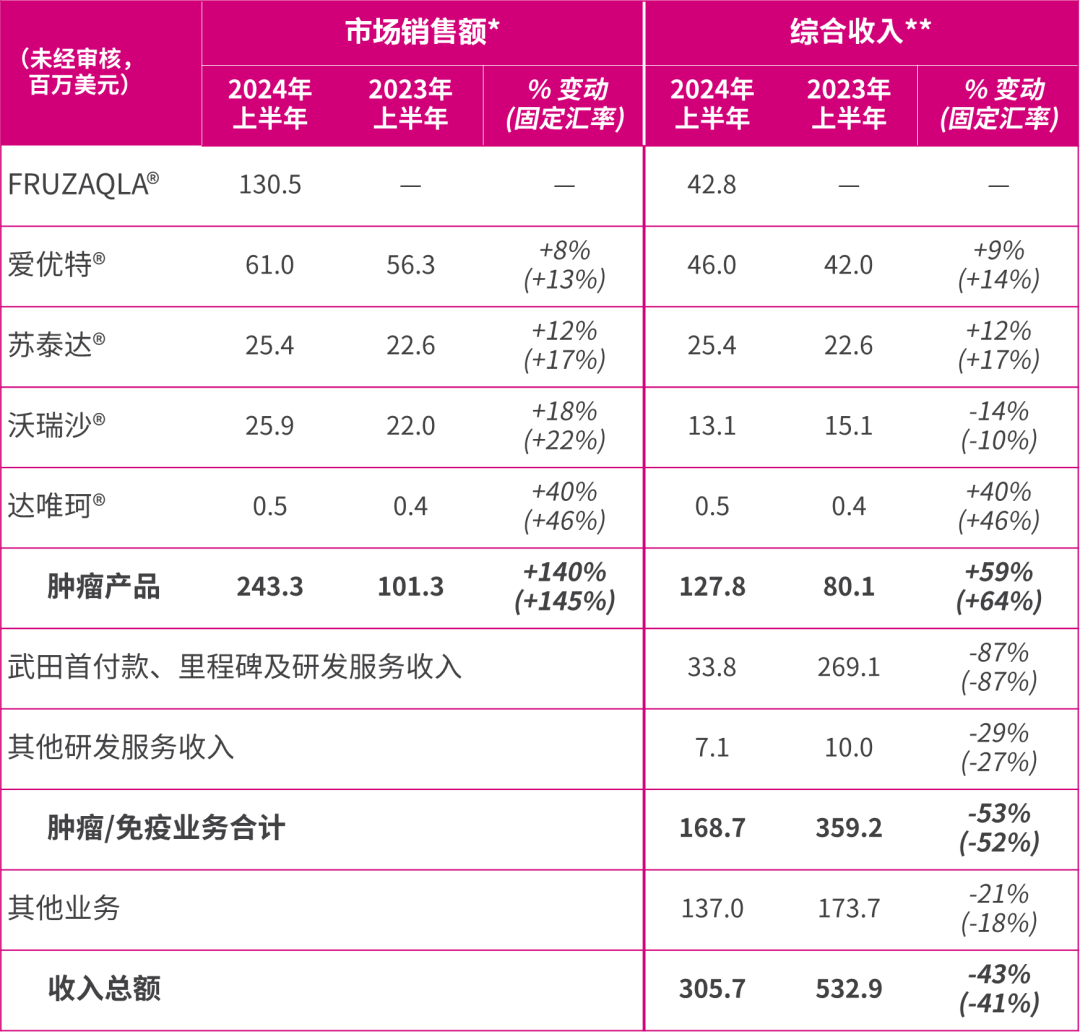
** =就FRUZAQLA®,代表武田支付的药品供应和特许权使用费;就爱优特®,代表礼来向和黄医药支付的药品供应、商业服务费和特许权使用费以及由和黄医药开具发票的对其他第三方的销售额;就沃瑞沙®,代表阿斯利康向和黄医药支付的药品供应和特许权使用费以及由和黄医药开具发票的对其他第三方的销售额;以及就苏泰达®及达唯珂®,代表公司对第三方的产品销售额。
二. 注册审批进展
赛沃替尼用于一线和二线治疗MET外显子14跳变非小细胞肺癌的新适应症上市申请[19]于2024年获国家药监局[20]受理; 2024年1月,呋喹替尼在中国香港获批用于三线治疗结直肠癌; 呋喹替尼用于二线治疗子宫内膜癌的新适应症上市申请于2024年年初获国家药监局受理并获纳入优先审评; 2024年5月,他泽司他在中国香港获批用于治疗复发/难治性[21]滤泡性淋巴瘤;及 2024年7月,他泽司他用于治疗复发/难治性滤泡性淋巴瘤的新药上市申请获国家药监局受理并获纳入优先审评。
中国以外 :
呋喹替尼于2024年4月取得欧洲药品管理局[22]人用药品委员会的积极意见,用于治疗经治的转移性结直肠癌,并随后于2024年6月在欧盟获批。
三. 后期临床项目进展
完成SAVANNAH研究的患者招募 (NCT03778229),该关键性全球II期研究在因MET扩增或过表达导致泰瑞沙®治疗后疾病进展的非小细胞肺癌患者中展开,已获快速通道开发项目资格,并有望于美国申请加速审批。在该患者群体中进行的一项小型平行研究(NCT04606771) 于AACR[24]年会上发表的数据亦证实了该联合疗法拥有更高的临床活性,且安全性与各项治疗的已知特征保持一致;及 多项研究继续入组中,包括SAFFRON研究 (NCT05261399),这项在该患者群体中展开的与泰瑞沙®联合疗法的全球关键性III期研究,将为SAVANNAH研究提供进一步支持;SACHI研究 (NCT05015608),一项在EGFR [25] 抑制剂治疗后疾病进展的中国患者中开展的类似的关键性III期研究,以及 SANOVO研究 (NCT05009836),一项用于一线治疗伴有EGFR突变和MET过表达的中国患者的关键性III期研究。
赛沃替尼潜在的临床和监管关键进展 :
于2024年年底完成SACHI研究的患者招募;及 于2024年年底左右,基于SAVANNAH研究 (若取得积极结果) 向美国FDA[26]提交新药上市申请。
呋喹替尼 (中国商品名:爱优特®,海外商品名:FRUZAQLA® ) 是一种高选择性的VEGFR [27] 1/2/3口服抑制剂,旨在提高激酶选择性,从而降低脱靶毒性
FRUSICA-1研究结果公布,这是一项与信迪利单抗 (sintilimab) 联合疗法用于治疗伴有pMMR[28]状态的子宫内膜癌患者的II期注册研究,无论既往是否接受过贝伐珠单抗 (bevacizumab) 治疗,该联合疗法均展现出具有意义的疗效改善及可控的毒性特征 (NCT03903705) ;
FRESCO-2研究的亚组分析于ASCO [29] 年会公布、生物标志物分析于AACR年会公布,及生活质量分析于ASCO GI [30] 会议公布 (NCT04322539)。分析表明,无论既往接受的治疗种类或顺序如何,该疗法均是有效的,癌胚抗原[31]反应可能是疗效改善的早期预测因素,以及在既往接受治疗的结直肠癌患者中展现出具有临床意义的生活质量调整后的生存获益;及
继于ASCO全体大会系列会议上首次公布后,FRUTIGA研究结果于《自然·医学》及ASCO年会上同步发表 (NCT03223376),这是一项与紫杉醇联合疗法用于治疗胃癌患者的中国研究。PFS[32]、ORR[33]和DCR[34]均取得具有统计学意义的显著改善,尽管整体OS[35]改善未达统计学意义,但在排除接受后续抗肿瘤治疗的患者后的预设分析中,OS改善达到了统计学意义上的显著改善。
呋喹替尼潜在的临床和监管关键进展 :
于2024年年底完成治疗经治转移性结直肠癌的PMDA[36]新药上市申请审评;及 若到达所需的PFS事件数量,于年底左右公布用于治疗肾透明细胞癌[37]的 II/III期注册研究FRUSICA-2的顶线结果 (NCT05522231)。
索乐匹尼布 (HMPL-523) 是一种研究性的高选择性口服Syk抑制剂,Syk是Fc受体和B细胞受体信号传导通路的关键组成部分
ESLIM-01研究结果于《柳叶刀·血液病学》及EHA[38]年会上同步发表,这是一项用于治疗原发性免疫性血小板减少症成人患者的中国研究 (NCT05029635)。索乐匹尼布治疗不仅展现出具有临床意义的快速且持久的48.4%的持续应答率以及可耐受的安全性特征,还显著改善了患者的生活质量,且无论患者既往的治疗线数、既往TPO/TPO-RA[39]治疗情况或类型,均带来一致的临床获益; 用于治疗温抗体型自身免疫性溶血性贫血患者的中国II期概念验证研究结果于EHA年会上发表,展现出良好的安全性特征以及令人鼓舞的血红蛋白获益;及 基于这一积极的数据,启动了该研究的III期阶段,即ESLIM-02研究 (NCT05535933)。
索乐匹尼布潜在的临床和监管关键进展 :
于2024年年中在美国/欧洲启动一项用于治疗免疫性血小板减少症的剂量探索研究 (NCT06291415);及 于年底左右完成基于 ESLIM-01研究的国家药监局新药上市申请审评。
索凡替尼 (中国商品名: 苏泰达®) 是一种VEGFR、FGFR [40]及CSF-1R [41]的口服小分子抑制剂,旨在用于抑制肿瘤血管生成,并通过调节肿瘤相关巨噬细胞以促进对肿瘤细胞的免疫应答
在中国启动了一项用于治疗初治转移性胰腺导管腺癌的II/III期研究,联合PD-1 [42]抗体卡瑞利珠单抗 (camrelizumab) 、白蛋白结合型紫杉醇 (nab-paclitaxel) 及吉西他滨 (gemcitabine) (NCT06361888)。该研究展开的部分依据是一项类似的由研究者发起的联合疗法研究,其数据已于2024年ASCO GI会议上公布。据估计,每年全球约有51.1万名患者被诊断患有这种高度侵袭性的癌症。
他泽司他 (中国海南、澳门及香港商品名:达唯珂®) 是一种同类首创EZH2口服抑制剂
有望于2025年年中完成中国新药上市申请审评,用于治疗复发/难治性滤泡性淋巴瘤。
HMPL-453是一种新型、高选择性及强效的FGFR 1/2/3抑制剂
继续II期注册研究的患者招募,用于治疗伴有FGFR 2融合的肝内胆管癌[43] (NCT04353375)。
HMPL-306是一种IDH1和IDH2酶的研究性高选择性口服双重抑制剂,而这些酶被认为是某些血液恶性肿瘤、神经胶质瘤和实体瘤的驱动因素
中国和美国/欧洲I期研究的结果于EHA年会公布,展现出其作为治疗IDH1和/或IDH2突变型复发/难治性急性髓系白血病的有效疗法的潜力 (NCT04272957、NCT04764474) ;及
启动RAPHAEL中国III期研究,用于治疗IDH1和/或IDH2突变的复发/难治性急性髓系白血病 (NCT06387069)。
其他早期研究性候选药物
于AACR、ASCO和EHA年会上公布了ERK1/2[44]抑制剂HMPL-295、第三代BTK抑制剂HMPL-760、Menin抑制剂HMPL-506,以及CD38 抗体偶联药物[45]HMPL-A067的临床前和I期结果;及
于中国启动HMPL-506的I期研究,用于治疗血液恶性肿瘤 (NCT06387082)。
四. 合作最新进展
两款由和黄医药发现的候选药物在创响生物[46]的推动下取得进一步临床进展
继创响生物行使独家许可选择权以进一步开发、生产和商业化IMG-007 (一种非消耗性抗OX40抗体) 和IMG-004 (一种可逆性、非共价、高选择性的口服BTK抑制剂) 后,获得创响生物约7.5% (完全稀释) 的股份; 创响生物宣布了IMG-007用于治疗特应性皮炎的IIa期试验的积极中期结果。治疗令特应性皮炎患者的皮肤体征得到快速、显著和持久的改善,同时总体耐受性良好。最终结果预计将于2024年第三季度晚些时候公布。创响生物还完成了斑秃IIa期试验的患者招募;及 创响生物宣布了IMG-004多剂量递增研究的积极顶线结果,表明每日一次给药的可行性。该药物在每日一次的剂量范围内服用10天均能良好耐受,没有肝酶升高或出血事件报告。初步模型和数据支持每日一次50毫克作为潜在的治疗剂量,并进一步开发作为BTK介导的免疫性疾病的差异化治疗。
五. 其他业务
其他业务收入主要来自我们在中国的处方药营销及分销业务。综合收入下降了21% (按固定汇率计算为18%) 至1.370亿美元 (2023年上半年:1.737亿美元),主要是由于与新冠肺炎相关的处方药的分销销售额于2024年下降。 非合并合资企业上海和黄药业[47]的收入下降4% (按固定汇率计算为持平)至2.252亿美元 (2023年上半年:2.353亿美元),主要受到麝香保心丸在几个高定价省份的定价降低影响,该举措旨在标准化麝香保心丸的定价结构,以为可能在全国范围实施的带量采购做好准备。 和黄医药应占其他业务的综合净收益减少8% (按固定汇率计算为4%) 至3,410万美元 (2023年上半年:3,720万美元),主要是由于上海和黄药业因带量采购价格影响及增加研发开支,导致其贡献的净收益减少,为3,380万美元 (2023年上半年:3,510万美元)。 我们持续探索将合资企业上海和黄药业的潜在价值转化为实际价值的可能性,包括各种出售和合作备选方案。
六. 可持续发展
汇率影响: 2024年上半年,人民币兑美元平均贬值约4%,这影响了我们的综合财务业绩,要点如下。
于2024年6月30日,现金及现金等价物和短期投资合计为8.025亿美元,而于2023年12月31日为8.863亿美元。
于2024年上半年,不包括融资活动的调整后的集团 (非GAAP[49]) 净现金流为-5,130万美元 (2023年上半年:2.193亿美元),主要是由于经营活动所用净现金3,980万美元及资本支出1,010万美元;及 2024年上半年融资活动使用的净现金合计为3,260万美元,乃由于购买了3,610万美元的股权奖励(2023年上半年:融资活动产生的净现金为580万美元)。
截至2024年6月30日止六个月收入为3.057亿美元,而截至2023年6月30日止六个月为5.329亿美元。
肿瘤/免疫业务综合收入为1.687亿美元 (2023年上半年:3.592亿美元),包括:
收入成本下降14%至1.801亿美元 (2023年上半年:2.083亿美元),其中源自其他业务的收入成本下降,但是被我们已上市产品的销售额增加,以及因销售团队扩大而为爱优特®推广和营销服务的成本增加所抵消;
研发开支减少34%至9,530万美元 (2023年上半年:1.446亿美元),主要由于我们对管线产品,特别是中国境外的管线产品进行战略优先排序所致。美国和欧洲的临床和监管申报费用为1,490万美元 (2023年上半年:5,560万美元) ,而中国的研发开支为8,040万美元 (2023年上半年:8,900万美元) ;
销售及行政开支[51]为5,780万美元 (2023年上半年:6,830万美元),减少主要由于我们对支出进行了更严格的控制,同时利用现有的基础设施来推动进一步的收入增长;及
其他项目主要包括上海和黄药业的合资企业权益收益、利息收入和支出,外汇和税务产生净收益5,330万美元 (2023年上半年:5,690万美元),此下降主要由于该期间确认的汇兑收益降低。
截至2024年6月30日止六个月和黄医药应占净收益为2,580万美元,而截至2023年6月30日止六个月为1.686亿美元。
截至2024年6月30日止六个月,和黄医药应占净收益为每股普通股0.03美元/每份ADS[51]0.15美元 (2023年上半年:每股普通股0.20美元/每份ADS 1.00美元)。
我们重申肿瘤/免疫业务综合收入的2024年全年指引为3亿至4亿美元,主要得益于已上市的肿瘤产品30%至50%的目标收入增长。在2024年以及往后,和黄医药的工作将得到其强劲的财务状况的支持。因此,公司完全有能力实现其建立自给自足可持续的业务,以及透过其在中国市场的销售网络和全球合作伙伴将创新药物带向全球患者的目标。
我们不保证财务指引中包含的陈述将实现,或其中包含的财务结果将实现或可能实现;及 我们过去曾修订我们的财务指引,应参考我们在本公告刊发日期后就任何财务指引更新的公告。
非GAAP财务指标的使用和调节 — 本公告中提及不包括融资活动的调整后集团净现金流及按照按固定汇率计算报告的财务指标均基于非GAAP财务指标。请参见"非GAAP财务指标的使用和调节",以分别了解这些财务指标的解释,以及这些财务指标与最具可比性的GAAP指标调节的进一步资料。

除非文意另有所指外,否则本公告中所称 "集团"、"公司"、"和黄医药"、 "和黄医药集团"、 "我们" 和 "我们的" 指和黄医药 (中国) 有限公司及其附属公司,除非文中另有说明或指明。
过往业绩和前瞻性陈述
医疗信息
本公告所提到的产品可能并未在所有国家上市,或可能以不同的商标进行销售,或用于不同的病症,或采用不同的剂量,或拥有不同的效力。本文中所包含的任何信息都不应被视为是任何处方药的申请、推广或广告,包括那些正在研发的药物。
参考资料及简称缩写:





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论