1.5.1 本周全球TOP10创新药研发进展
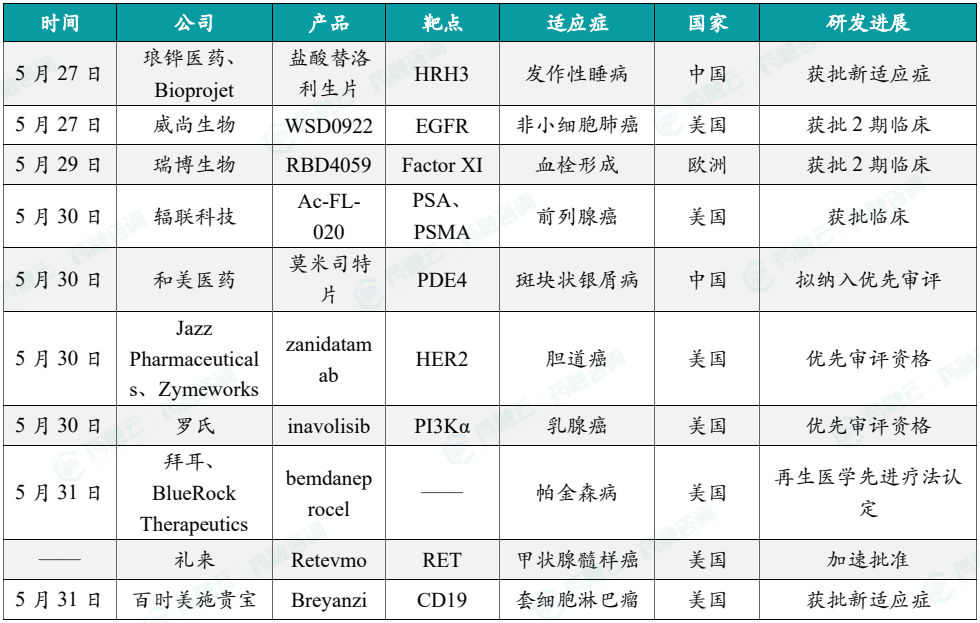
(1)琅铧医药与Bioprojet的替洛利生获批新适应症,治疗发作性睡病
5月27日,琅钰集团旗下子公司琅铧医药和Bioprojet公司共同申报的盐酸替洛利生片新适应症上市申请获得批准。根据CDE优先审评公示以及公开资料,替洛利生是⼀种选择性组胺H3受体反向激动剂,本次获批的适应症为:治疗发作性睡病青少年和6岁以上儿童患者的日间过度嗜睡或猝倒。公开资料显示,替洛利生(pitolisant)是由Bioprojet公司研发的⼀种选择性组胺H3受体反向激动剂。该药通过一种全新的作用机制发挥作用,即通过增强组胺能神经元活性,增加大脑中促进觉醒的神经递质组胺的合成和释放,进而提高患者的清醒度和警觉性。
(2)威尚生物新型EGFR抑制剂获FDA批准2期临床
5月27日,威尚生物医药宣布FDA批准其新型EGFR抑制剂WSD0922在美国开展2期临床试验,用于经一线奥希替尼治疗进展具C797S突变的晚期/转移性非小细胞肺癌。根据威尚生物医药新闻稿,WSD0922是该公司自主研发的一款具有穿透血脑屏障潜力的第四代EGFR/EGFRvIII靶向抑制剂,拟开发适应症为非小细胞肺癌神经中枢转移及脑部肿瘤。该药具有克服多种一线奥希替尼耐药机制的潜力,并可用于治疗EGFRvIII驱动的脑胶质母细胞瘤(GBM)和间变型胶质瘤(AA)。
(3)瑞博生物siRNA新药在欧洲获批2期临床
5月29日,瑞博生物宣布其自主研发的靶向FXI的抗血栓siRNA药物RBD4059于近日获得欧洲药品管理局(EMA)2期临床试验许可。RBD4059是瑞博生物基于其肝靶向技术平台开发的GalNac偶联siRNA药物,通过抑制凝血因子XI(FXI)和阻断内源性凝血途径的激活,从而实现其抗凝血/抗血栓的作用。FXI是内源凝血途径的关键分子,越来越多的研究表明通过抑制FXI可以阻断内在凝血途径,可为临床患者提供一种新的有效的低出血风险的抗血栓手段。据瑞博生物新闻稿介绍,与目前的治疗手段相比,抑制FXI有望成为一种更有效的抗血栓治疗方法,且出血风险较小。
(4)辐联科技PSMA靶向RDC在美国获批临床
5月30日,辐联科技宣布,其PSMA靶向放射性药物225Ac-FL-020已获得美国FDA新药临床试验(IND)的批准,用于治疗转移性去势抵抗性前列腺癌(mCRPC)。225Ac-FL-020是辐联科技正在开发的创新型下一代PSMA靶向放射性核素药物偶联物(RDC)。该药物旨在治疗mCRPC,并将于2024年进入全球1期临床研究。据辐联科技新闻稿介绍,该产品的靶向载体FL-020运用了辐联科技专有的UniRDC™平台研发而成,该技术能显著增强药物在肿瘤部位的摄取效率,同时确保快速的全身清除。在临床前模型中,225Ac-FL-020展现出了令人期待的抗肿瘤效果和良好的安全性。此外,225Ac-FL-020采用靶向α放射疗法,可精准靶向癌症细胞,减少对健康组织的损伤。
(5)和美药业PDE4抑制剂拟纳入优先审评,针对斑块状银屑病
5月30日,和美药业申报的莫米司特片(Hemay005片)拟纳入优先审评,针对适应症为中度至重度斑块状银屑病。公开资料显示,这是和美药业自主研发的一款小分子PDE4抑制剂。2024年4月,莫米司特片的上市申请被CDE受理,这也是本次获拟纳入优先审评的适应症。根据和美药业此前新闻稿,莫米司特片已经完成治疗中重度斑块状银屑病的临床3期试验。其中,在该研究中,接受莫米司特片治疗16周的患者中达成PASI75的比例53.6%;持续使用达成PASI75的比例进一步提升到70%以上。同时,在该试验中,和美药业还在治疗银屑病的试验中纳入了上百例T-SPOT检测阳性的非活动结核患者,试验过程中无重新激活结核发病现象。
(6)Jazz和Zymeworks双抗zanidatamab获FDA优先审批资格,治疗胆道癌
5月30日,Jazz Pharmaceuticals和Zymeworks共同宣布,美国FDA已接受其在研HER2靶向双特异性抗体zanidatamab的生物制品许可申请(BLA)并授予优先审评资格,用以治疗经治、不可切除、局部晚期或转移性HER2阳性胆道癌(BTC)患者。Zanidatamab是一种具有新作用机制的HER2靶向在研双特异性抗体,可靶向HER2蛋白上两个不重复的抗原表位。Zanidatamab与HER2的结合可以阻断其信号传递、促进HER2自细胞表面移除,并已显示在几种表达HER2的癌症中具抗肿瘤活性,无论是作为单药还是与化疗或其他药物联合使用。根据新闻稿,如果获得批准,zanidatamab将成为FDA批准用于治疗HER2阳性局部晚期或转移性BTC患者的首个HER2靶向药物。
(7)罗氏小分子联合疗法获优先审评资格,降低晚期乳腺癌死亡风险达57%
5月30日,罗氏公司宣布,美国FDA已经接受其在研、潜在“best-in-class”口服小分子inavolisib联合CDK4/6抑制剂Ibrance(palbociclib)和氟维司群(fulvestrant)的新药申请(NDA),并授予优先审评资格,用于治疗肿瘤带有PIK3CA突变、激素受体(HR)阳性、人类表皮生长因子受体2(HER2)阴性局部晚期或转移性乳腺癌成年患者,这些患者在完成辅助内分泌治疗后12个月内发生复发。Inavolisib是一种口服疗法,具有高度的体外PI3Kα抑制效力和选择性,能够特异性触发PI3Kα蛋白突变体的分解。通过这种独特的双重作用机制,inavolisib可能为HR阳性/HER2阴性、PIK3CA突变的晚期乳腺癌患者提供耐受良好、持久的疾病控制和潜在改善的结局。约有40%的HR阳性乳腺癌患者带有PIK3CA基因突变,该突变可能导致肿瘤生长失控、疾病进展和对内分泌治疗的耐药性。
(8)拜耳细胞疗法获FDA再生医学先进疗法认定,治疗帕金森病
5月31日,拜耳和其子公司BlueRock Therapeutics宣布,BlueRock用于治疗帕金森病的在研细胞疗法bemdaneprocel(BRT-DA01)获得美国FDA的再生医学先进疗法(RMAT)认定。Bemdaneprocel是一种在研细胞疗法,由多能干细胞衍生、可产生多巴胺的神经元组成,可通过手术植入帕金森病患者的大脑。当这些细胞被移植后,它们有可能重建帕金森病患者脑内受破坏的神经网络,借此恢复患者的运动和非运动功能。
(9)礼来小分子抑制剂再获FDA加速批准
近日,美国FDA宣布,加速批准礼来公司开发的Retevmo(selpercatinib)治疗2岁及以上儿童患者,适应症包括:需要全身性治疗的RET突变晚期或转移性甲状腺髓样癌(MTC);携带RET基因融合且放射性碘治疗无效的晚期或转移性甲状腺癌;携带RET基因融合,接受全身性治疗后疾病进展或没有满意替代治疗方案的局部晚期或转移性实体瘤。Retevmo是一款强效RET激酶抑制剂,它在2020年首次获得美国FDA加速批准,治疗非小细胞肺癌(NSCLC)、MTC和甲状腺癌这三种癌症。这些患者肿瘤的RET基因出现融合或者突变。新闻稿指出,这是FDA首次批准用于12岁以下RET基因变异儿童患者的靶向疗法。Retevmo之前已获得加速批准用于成人和12岁以上儿童的甲状腺癌适应症,以及成人的实体瘤适应症。
(10)百时美施贵宝CAR-T疗法扩展适应症,用于套细胞淋巴瘤
5月31日,百时美施贵宝宣布,美国FDA已批准其CAR-T疗法Breyanzi(lisocabtagene maraleucel;liso-cel)的扩展适应症,用于既往接受过至少2线系统性疗法的复发性或难治性套细胞淋巴瘤(MCL)成人患者,包括曾接受过布鲁顿酪氨酸激酶(BTK)抑制剂治疗的患者。Breyanzi是一种靶向CD19抗原的自体CAR-T细胞疗法,具有明确的组成和4-1BB共刺激域。根据新闻稿,Breyanzi是首个获美国FDA批准用于治疗四种不同亚型非霍奇金淋巴瘤的CAR-T疗法,使之能够治疗广泛的B细胞恶性肿瘤患者群体。
1.5.2本周全球TOP10积极/失败临床结果
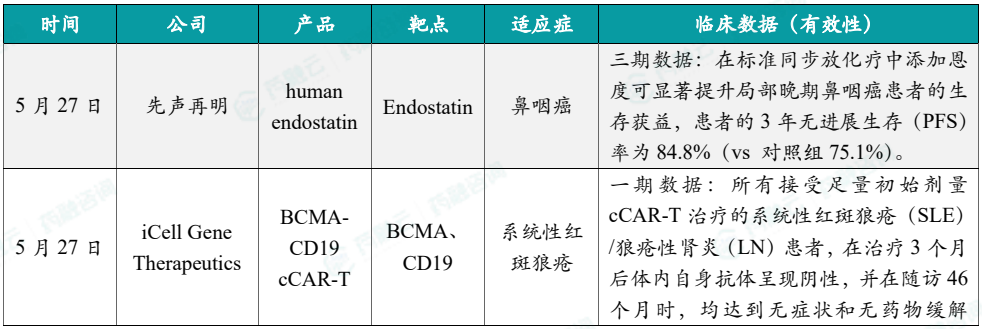

(1)先声再明公布human endostatin治疗鼻咽癌3期数据,3年PFS率近85%
5月27日,先声药业旗下先声再明公布重组人血管内皮抑制素human endostatin(恩度)的鼻咽癌3期数据,数据显示,在标准同步放化疗中添加恩度可显著提升局部晚期鼻咽癌患者的生存获益,主要终点患者的3年无进展生存(PFS)率为84.8%(vs 对照组75.1%)。次要终点同步放化疗+恩度组的3年OS率为89.2%(vs 85.3%),3年DMFS率为89.7%(vs 80.5%),3年LRRFS率为91.5%(vs 90.8%),均高于同步放化疗组。
(2)iCell Gene CAR-T疗法1期实验积极结果公布
5月27日,iCell Gene Therapeutics今天宣布其BCMA与CD19靶向复合嵌合抗原受体-T(BCMA-CD19 cCAR-T)细胞免疫疗法的研究者发起临床试验(IIT)的积极结果。分析显示,所有接受足量初始剂量cCAR-T治疗的系统性红斑狼疮(SLE)/狼疮性肾炎(LN)患者,在治疗3个月后体内自身抗体呈现阴性,并在随访46个月时,均达到无症状和无药物缓解(MFR)。
(3)信达生物IL-23p19抗体注射液匹康奇拜单抗达3期实验终点,拟申报上市
5月28日,信达生物宣布其自主研发的重组抗白介素23p19亚基(IL-23p19)抗体注射液匹康奇拜单抗在中国中重度斑块状银屑病受试者中开展的3期临床研究(CLEAR-1)中达成主要终点和所有关键次要终点。匹康奇拜单抗(研发代号:IBI112)为重组抗IL-23p19抗体注射液,可特异性结合IL-23p19亚基。通过阻止IL-23与细胞表面受体结合,阻断IL-23受体介导信号通路发挥抗炎作用,有望为银屑病和其他自身免疫性疾病患者提供更有效的治疗方案。据信达生物新闻稿介绍,CLEAR-1两个主要终点均达成:第16周时,匹康奇拜单抗合计组PASI 90和sPGA 0/1分的受试者比例分别达到80.3%和93.5%,均显著优于安慰剂组(2.0%和13.1%)。
(4)Merus双抗组合疗法1/2期积极结果公布,治疗头颈癌
5月29日,Merus公布其在研双特异性抗体petosemtamab与PD-1抑制剂pembrolizumab作为一线联合疗法,治疗头颈癌患者的1/2期临床试验的积极数据。在此中期数据中,接受petosemtamab联合疗法患者的总缓解率达67%,无论患者肿瘤PD-L1表达水平与人类乳头瘤病毒(HPV)状态为何。Petosemtamab是通过Merus公司Biclonics平台所开发的一款在研EGFR和LGR5靶向的抗体依赖的细胞毒性(ADCC)增强型IgG1双特异性抗体。据Merus公司官网资料介绍,在临床前模型中,petosemtamab可以结合并触发表达LGR5的肿瘤干细胞中的EGFR降解。该产品通过两种作用机制发挥抗癌作用:通过阻断癌症起始细胞的生长和生存途径;通过免疫效应细胞的招募和增强,直接杀死实体肿瘤中持续存在并可能导致复发和转移的癌症起始细胞。
(5)NewAmsterdam CETP抑制剂积极结果公布,治疗高胆固醇血症
5月29日,NewAmsterdam Pharma公布其在研CETP抑制剂obicetrapib在临床2期试验ROSE1和ROSE2中治疗高胆固醇血症患者的积极数据。分析显示,与安慰剂相较,obicetrapib与高强度他汀类药物联用可降低患者脂蛋白(a)——Lp(a)水平达57%。Obicetrapib是一款口服、选择性CETP抑制剂。CETP是一种将胆固醇从高密度脂蛋白胆固醇(HDL-C,又称为好胆固醇)中转移到LDL-C(又称为坏胆固醇)中的转运蛋白。Obicetrapib通过阻断CETP的功能,能够在显著降低LDL-C的同时,显著提高HDL-C的水平。过去研究显示,丢失CETP功能的人群患上代谢类疾病(比如冠心病、糖尿病)的风险显著降低。这是一个经过人类遗传学验证的靶点。
(6)Insmed DPP1小分子抑制剂达3期实验主要终点,治疗非囊性纤维化支气管扩张
5月29日,Insmed宣布了3期临床试验ASPEN的积极顶线结果,在主要终点方面,10 mg和25 mg剂量的brensocatib分别将患者的年化PE率降低21.1%和19.4%,统计学显著并具有临床意义。Brensocatib是一种口服、可逆性DPP1小分子抑制剂。DPP1是一种酶,负责激活中性粒细胞中的中性粒细胞丝氨酸蛋白酶(NSPs)。中性粒细胞是最常见的白细胞类型,在杀伤病原体和介导炎症中起着必不可少的作用。在慢性炎症性肺病中,中性粒细胞在气道中聚集并导致NSP过度活跃,从而引起肺组织损伤和炎症。Brensocatib可以通过抑制DPP1降低NSPs的活化,从而降低炎症性疾病(如支气管扩张)的组织损伤。
(7)默沙东PD-1抑制剂Keytruda 3期实验积极结果公布
5月29日,默沙东宣布其重磅PD-1抑制剂Keytruda(pembrolizumab)于3期临床试验KEYNOTE-522中获得积极结果。在该试验中Keytruda联合化疗作为术前新辅助疗法并同时作为术后单药辅助疗法,用于治疗高危早期三阴性乳腺癌(TNBC)患者。分析结果显示,在64.8%的Keytruda+化疗组患者(n=260/401)中观察到pCR,较化疗+安慰剂组(n=103/201)的51.2%增加了13.6%(p=0.00055)。在中位随访39个月后,试验达到EFS的另一主要终点,与对照组相比,Keytruda将事件或死亡风险降低了37%(HR=0.63,95% CI:0.48-0.82,p<0.001)。共有15.7%(n=123/784)接受Keytruda方案治疗的患者发生了EFS事件,此数值在对照组为23.8%(n=93/390)。Keytruda组估计的3年EFS率为84.5%(95% CI:81.7-86.9),而对照组为76.8%(95% CI:72.2-80.7)。
(8)强生Orexin-2受体拮抗剂Seltorexant达3期实验终点,显著缓解抑郁症
5月30日,强生公司宣布,3期临床试验MDD3001的顶线结果显示,这项随机双盲、含安慰剂对照的3期临床研究达到了所有主要和次要终点。接受seltorexant治疗的患者在第43天基于蒙哥马利-阿斯伯格抑郁评分表(MADRS)总评分显示抑郁症状具有统计学显著性和临床意义的改善,并在先前单独使用传统抗抑郁药疗效不佳的患者中显示出睡眠障碍的改善。Seltorexant在研究中表现出良好的安全性和耐受性,两个试验组中常见不良事件的发生率相似Seltorexant是强生与Minerva Neurosciences公司共同开发的治疗MDD的抗抑郁疗法。它是一款潜在“first-in-class”的口服特异性食欲素-2受体抑制剂。
(9)阿斯利康PCSK9小分子抑制剂1期实验结果积极,降低胆固醇水平近80%
5月30日,阿斯利康公布其在研口服PCSK9抑制剂AZD0780于1期临床试验中取得积极结果。分析显示,在未经治疗的高胆固醇血症患者中,AZD0780在基于瑞舒伐他汀治疗的基础上,显示出52%(95% CI:-57,-45)的LDL-C水平显著下降,与基线相比患者的LDL-C总体下降幅度达78%。此外,比较进食与空腹服药的初步数据表明AZD0780对进食具有灵活性。未报告严重不良事件,AZD0780显示良好的耐受性。血浆中LDL-C水平升高是心血管疾病的主要风险因素,估计每年导致全球约260万人死亡。AZD0780是一种口服、潜在“first-in-class"的PCSK9小分子抑制剂,开发用于治疗无法通过他汀类药物控制的血脂异常患者。
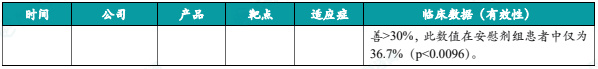
(10)Soterios创新疗法STS-01 2期实验积极结果公布,治疗轻中度斑秃
5月31日,Soterios Pharma公布其在研药品STS-01用于治疗轻度/中度斑秃患者的临床2期试验积极结果。分析显示,在24周时,75.9%接受每日一次1% STS-01局部给药治疗的患者达到主要疗效终点,即SALT评分改善>30%,此数值在安慰剂组患者中仅为36.7%(p<0.0096)。试验亦达到多个次要终点,在接受1%和2% STS-01治疗的患者中观察到显著的毛发再生长。接受1%和2% STS-01治疗的患者中,分别有19%和27%达到100%头皮毛发覆盖率(即SALT=0),而仅有3%安慰剂组患者达到此标准,STS-01同时显示出明显的剂量反应。安全性方面,STS-01耐受性良好,无重大不良事件。
同期事件:
1. 2024年第22周05.27-06.02国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第22周05.27-06.02国内仿制药/生物类似物申报/审批数据分析
3. 2024年第22周05.27-06.02国内医药大健康行业政策法规汇总
4. 2024年第22周05.27-06.02全球医药大健康行业投融资数据
以上内容均来自{摩熵资讯医药行业观察周报(2024.05.27-2024.06.02)},如需查看或下载报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询摩熵医药数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论