1.5.1 本周全球TOP10创新药研发进展
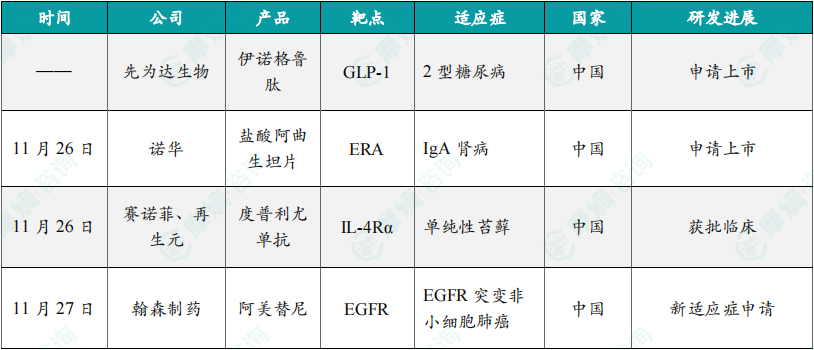
(1)先伟大生物GLP-1申报上市,用于2型糖尿病
近日,先为达生物开发的偏向型GLP-1受体激动剂新药——伊诺格鲁肽注射液的上市许可申请获中国国家药品监督管理局受理,用于成人2型糖尿病患者血糖控制适应症。根据先为达生物公开资料介绍,伊诺格鲁肽注射液是一种新型、脂肪酸修饰的长效GLP-1受体激动剂,其分子全部由天然氨基酸组成,与其他GLP-1类似物相比,生产工艺更为简化,且可实现每周给药一次。作为偏向型的GLP-1受体激动剂,伊诺格鲁肽具有优异的体外活性,偏向于cAMP通路的激活而非GLP-1受体的细胞内化。在啮齿类动物模型中,与非偏向型GLP-1受体激动剂相比,伊诺格鲁肽具有更显著的血糖控制和体重减轻效果。
(2)诺华肾病新药阿曲生坦在中国申报上市
11月26日,诺华在中国申报的1类新药盐酸阿曲生坦片上市申请获得受理。该药刚刚于几日前被纳入优先审评,适用于降低有疾病进展风险的原发性免疫球蛋白A肾病(IgAN)成人患者的蛋白尿。根据诺华公开资料介绍,atrasentan是一种有效的选择性口服ETA受体拮抗剂。ETA受体的激活导致蛋白尿升高,这与IgAN患者的肾脏损伤、纤维化和肾功能丧失有关。该药有可能被添加到目前的支持治疗(最大耐受剂量和稳定剂量的RAS抑制剂)中,以减少持续性蛋白尿和保护肾功能,适用于广泛的患者群体。
(3)赛诺菲/再生元的度普利尤单抗在中国再获批临床,针对单纯性苔藓
11月26日,赛诺菲在中国申报的度普利尤单抗注射液获批一项新的临床试验默示许可,拟开发用于治疗经外用药治疗控制不佳的中重度慢性单纯性苔藓成人患者。度普利尤单抗是美国FDA批准的首个抗IL-4Rα抗体,由赛诺菲和再生元联合开发。它能够通过IL-4和IL-13“双靶点”的创新作用机制阻断2型炎症通路,降低2型炎症的病理性反应,从机制上治疗2型炎症相关疾病。研究表明,IL-4和IL-13是2型炎症的关键驱动因素,在多种炎症性疾病中发挥重要作用。
(4)翰森制药阿美替尼第五项适应症申报上市
11月27日,翰森制药第三代EGFR-TKI新药甲磺酸阿美替尼片一项新适应症上市申请获得受理。公开资料显示,这是阿美替尼片在中国提交的第五个适应症上市申请。今年10月22日,翰森制药宣布,一项阿美替尼片联合化疗作为局部晚期(IIIB-IIIC期)或转移性(IV期)EGFR突变非小细胞肺癌(NSCLC)患者的一线治疗方案的3期注册试验AENEAS2达到了其主要终点即无进展生存期(PFS)。翰森制药表示该试验的详细数据将在未来医学会议上发布及向监管机构递交。由此推测,这可能为本次阿美替尼申报上市的适应症。
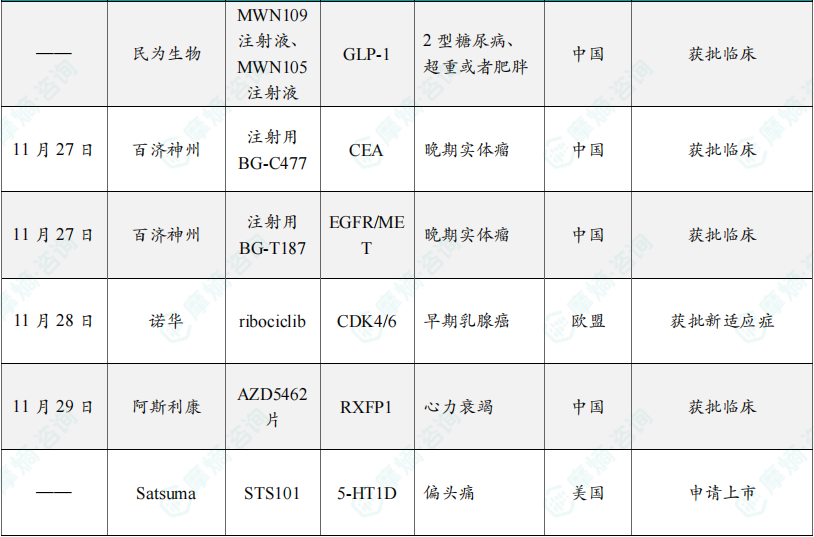
(5)民为生物两款GLP-1三靶点新药获批临床
近日,民为生物两款1类新药获得临床试验默示许可,分别为:MWN109注射液,一款GIP/GLP-1/GCG三靶点脂肪酸链修饰多肽药物;MWN105注射液,一款GIP/GLP-1/FGF21三靶点Fc融合蛋白药物。这两款新药均拟开发治疗2型糖尿病、超重或者肥胖。葡萄糖依赖性促胰岛素多肽(GIP)是一种肠促胰素,能够补充GLP-1受体激动剂的作用。研究已证明,GIP可减少摄食量并增加能量消耗,从而减轻体重,当联合GLP-1受体激动剂时,可能对葡萄糖水平和体重产生更大的影响。胰高血糖素(GCG)能够增加能量消耗,并且促进身体中储存能量的白色脂肪,转化为消耗能量的褐色脂肪,它能与GLP-1产生协同作用,促进比GLP-1受体激动剂单药更有效的体重减轻。成纤维细胞生长因子21(FGF21)是一种内源性代谢激素,可调节能量消耗以及葡萄糖和脂质代谢。FGF21主要表达于肝脏,是MASH治疗的重要靶点,在糖脂代谢调节中起着关键的作用。
(6)百济神州CEA的抗体偶联药物在中国获批临床,拟用于晚期实体瘤
11月27日,百济神州注射用BG-C477首次获得临床试验默示许可,BG-C477为一款靶向CEA的ADC。CEACAM5(CEA)是一种成熟的肿瘤相关抗原(TAA),在肺癌和胃肠道癌中有高表达。根据百济神州公开资料介绍,该产品具有差异化ADC设计以提升CEA阳性肺癌和胃肠道癌患者疗效,也可在中低表达患者中实现广泛靶向。差异化设计包括了利用拓扑异构酶I抑制剂作为有效载荷、高DAR(8)、稳定的偶联物和亲水性连接子设计。
(7)百济神州EGFR/MET三特异性抗体在中国获批临床,拟用于晚期实体瘤
11月27日,百济神州注射用BG-T187首次获得临床试验默示许可,BG-T187为一款EGFR x MET三特异性抗体,拟开发治疗肺癌和消化道癌症。EGFR和MET双重靶向可用于治疗大量EGFR突变的非小细胞肺癌人群以及其他EGFR或MET突变人群,如结直肠癌等。该产品具有差异化MET双表位设计,具有较好的MET抑制活性。
(8)诺华小分子药物ribociclib再获批准,治疗早期乳腺癌
11月28日,欧盟委员会批准CDK4/6抑制剂Kisqali(ribociclib)联合芳香酶抑制剂(AI),作为辅助疗法,治疗激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性的高复发风险早期乳腺癌(EBC)患者。Kisqali是一种选择性CDK4/6抑制剂,通过抑制CDK4和CDK6两种蛋白来减缓癌症进展。这些蛋白过度激活时会导致癌细胞快速生长和分裂。目前,Kisqali已被全球100多个国家和地区的监管机构批准用于乳腺癌治疗。
(9)阿斯利康RXFP1激动剂小分子药物在中国获批临床,拟治疗心力衰竭
11月29日,阿斯利康申报的1类新药AZD5462片获得临床试验默示许可,拟开发治疗心力衰竭。AZD5462片是一款小分子药物,为一款RXFP1激动剂。根据文献报道,在临床前研究中,AZD5462片激活了与松弛素H2高度相似的一系列下游通路。在食蟹猴心力衰竭模型中,AZD5462治疗8周后,在第9周、第13周和第17周观察到包括LVEF在内的功能性心脏参数的显著改善,而心率或平均动脉血压没有变化。研究还观察到AZD5462在大鼠和食蟹猴中均具有良好的耐受性,并已成功完成健康志愿者的1期研究。由此,AZD5462是RXFP1松弛素H2信号的小分子药理模拟物,有望成为心力衰竭患者的潜在治疗方法。
(10)Satsuma偏头痛疗法上市申请获FDA接受
近日,Satsuma Pharmaceuticals宣布,美国FDA已接受其在研鼻腔喷雾剂STS101重新提交的新药申请,用于急性治疗伴或不伴先兆的偏头痛。STS101是一种用于急性治疗偏头痛的创新在研疗法。基于已广泛使用的抗偏头痛药物甲磺酸二氢麦角胺(DHE),通过Satsuma专有的鼻部递送设备给药。STS101的设计旨在为患者提供快速且便捷的自我给药方式。Satsuma的鼻用粉末DHE制剂已显示出快速达到血浆药物浓度峰值,血浆药物浓度持续时间长以及多次给药之间差异性低等特点。
1.5.2本周全球TOP10积极/失败临床结果
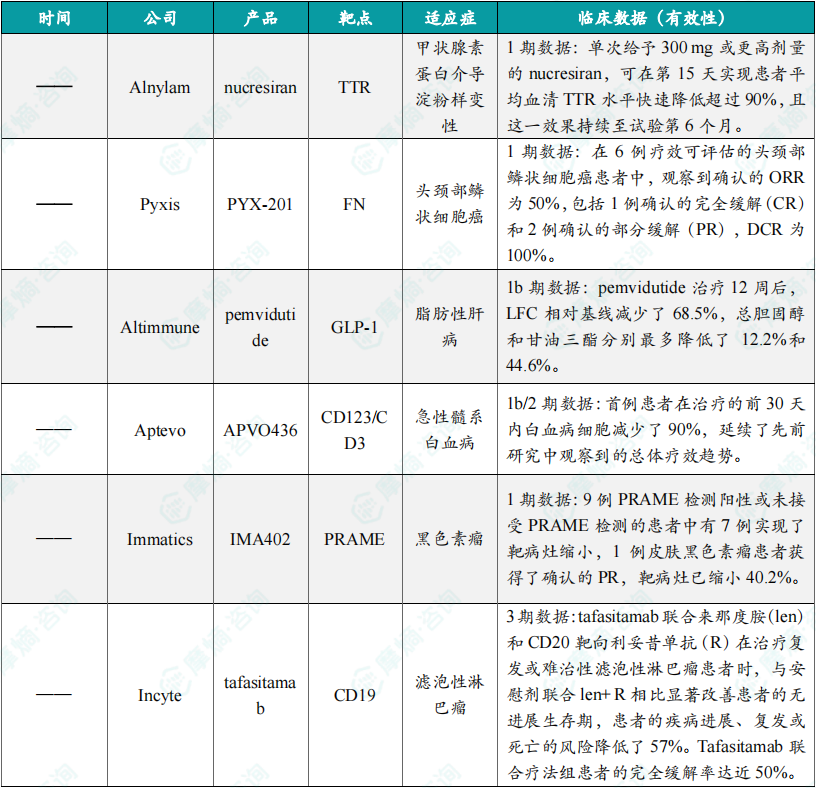
(1)Alnylam下一代RNAi疗法亮眼临床数据公布
近日,Alnylam Pharmaceuticals公司公布了其下一代RNAi疗法nucresiran(曾用名ALN-TTRsc04)用于治疗转甲状腺素蛋白介导淀粉样变性患者的1期临床研究的最新数据。Nucresiran通过Alnylam专有IKARIA平台所开发,旨在迅速降低突变型和野生型TTR的水平,从根本上治疗ATTR淀粉样变性。Nucresiran具有实现更深层次和更持久TTR快速降低的潜力,从而能够减少用药频率。此次公布的显示,单次给予300 mg或更高剂量的nucresiran,可在第15天实现患者平均血清TTR水平快速降低超过90%,且这一效果持续至试验第6个月。数据表明,nucresiran具有每半年或每年进行一次皮下注射的潜力。
(2)Pyxis抗体偶联药物PYX-201初步临床数据亮眼,晚期头颈鳞癌疾病控制率100%
近日,Pyxis Oncology公司公布了其候选抗体偶联药物PYX-201治疗多种类型实体瘤的1期剂量递增研究的初步积极数据。PYX-201以微管抑制剂(优化的auristatin)作为有效载荷,能独特地靶向肿瘤细胞外基质(ECM)中的一种非细胞结构成分——纤连蛋白B结构域(Extradomain-B Fibronectin,EDB+FN)。截至2024年10月4日的数据,在6例疗效可评估的头颈部鳞状细胞癌患者中,观察到确认的ORR为50%,包括1例确认的完全缓解(CR)和2例确认的部分缓解(PR),DCR为100%。
(3)Altimmune GLP-1/胰高血糖素双重受体激动剂治疗脂肪性肝病1b期结果公布
近日,Altimmune公司公布了pemvidutide治疗代谢功能障碍相关性脂肪性肝病(MASLD)的1b期试验的最新数据。Pemvidutide是一种GLP-1/胰高血糖素双重受体激动剂,数据显示,患者血浆中与心血管不良后果相关的多类炎症脂质有所减少。患者接受pemvidutide治疗12周后,LFC相对基线减少了68.5%,总胆固醇和甘油三酯分别最多降低了12.2%和44.6%。研究结果支持pemvidutide对MASH合并症的潜在益处,包括动脉粥样硬化、心脏病和代谢综合征。
(4)Aptevo双特异性重组蛋白APVO436 1b/2期临床结果公布
近日,Aptevo Therapeutics公司公布了其正在进行的1b/2期临床试验RAINIER中首例患者的治疗情况。该研究针对18岁及以上新确诊为急性髓系白血病且不符合强化诱导化疗条件的成人患者,旨在评估使用mipletamig联用标准治疗维奈托克和阿扎胞苷作为一线疗法的效果。APVO436是一种创新双特异性重组蛋白,它像两个单克隆抗体连接在一起,可以同时靶向肿瘤细胞表面的CD123和T淋巴细胞表面的CD3,从而将宿主免疫系统的T细胞重定向到患者的肿瘤细胞上,以快速和完全摧毁表面表达CD123的肿瘤细胞。此次公布的结果显示,首例患者在治疗的前30天内白血病细胞减少了90%,延续了先前研究中观察到的总体疗效趋势。
(5)Immatics双特异性分子IMA402的1期剂量递增试验数据公布
近日,Immatics公司公布了其下一代半衰期延长的T细胞受体(TCR)双特异性分子IMA402的1期剂量递增试验数据。IMA402靶向由HLA-A*02呈递的黑色素瘤抗原PRAME。PRAME是一种在各种实体瘤中经常表达的蛋白质,因此IMA402具潜力治疗广泛的癌症患者群体。截至2024年11月6日的数据,IMA402在接受治疗的33例患者中表现出良好的耐受性。最常见的治疗相关不良事件多为轻度至中度细胞因子释放综合征(CRS)和短暂的淋巴细胞减少症。早期药代动力学数据表明,IMA402的中位半衰期约为7天,有望支持每两周一次的给药方案。9例PRAME检测阳性或未接受PRAME检测的患者中有7例实现了靶病灶缩小,1例皮肤黑色素瘤患者获得了确认的PR,靶病灶已缩小40.2%。
(6)Incyte抗CD19单抗tafasitamab组合疗法达3期主要终点
近日,Incyte在美国血液学会年会摘要中,公布其CD19靶向单抗Monjuvi(tafasitamab)在关键性3期临床试验inMIND中获得积极结果。Tafasitamab是一种人源化细胞裂解性CD19靶向单克隆抗体。它的Fc结构域的修饰增强了抗体依赖性细胞介导的细胞毒性(ADCC)和抗体依赖性细胞吞噬作用(ADCP),介导B细胞裂解。分析显示,tafasitamab联合来那度胺(len)和CD20靶向利妥昔单抗(R)在治疗复发或难治性(R/R)滤泡性淋巴瘤(FL)患者时,与安慰剂联合len+ R相比显著改善患者的无进展生存期(PFS),患者的疾病进展、复发或死亡的风险降低了57%。Tafasitamab联合疗法组患者的完全缓解(CR)率达近50%。摘要结论指出,这项研究首次验证了两种单抗(抗CD19和抗CD20)联合用于治疗淋巴瘤的疗效,tafasitamab联合len + R有望成为R/R FL患者的新标准治疗方案。
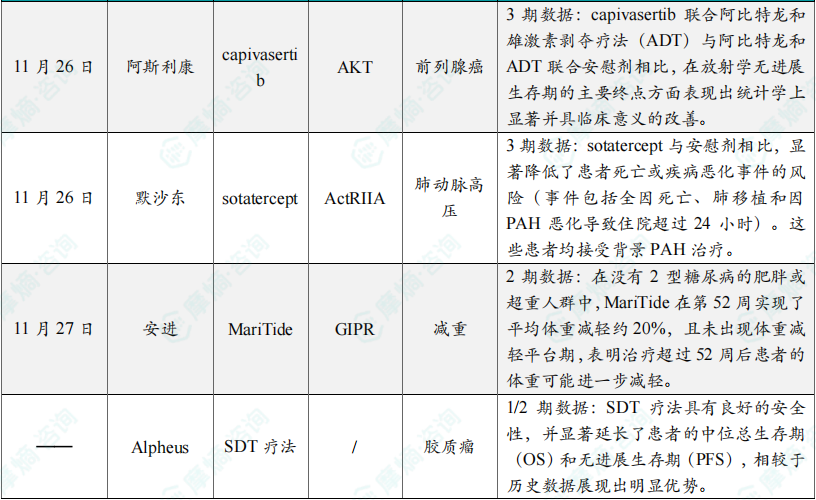
(7)阿斯利康AKT抑制剂组合达3期试验主要终点
11月26日,阿斯利康宣布CAPItello-281临床3期试验的积极结果。分析显示,对于PTEN缺陷型转移性激素敏感性前列腺癌(mHSPC)患者,阿斯利康的Truqap(capivasertib)联合阿比特龙(abiraterone)和雄激素剥夺疗法(ADT)与阿比特龙和ADT联合安慰剂相比,在放射学无进展生存期(rPFS)的主要终点方面表现出统计学上显著并具临床意义的改善。Truqap为一款具选择性、靶向3种AKT激酶异形体(AKT1/2/3)的腺苷三磷酸(ATP)竞争性抑制剂。根据新闻稿,Truqap组合是被证实对这种特定亚型前列腺癌有益的首个AKT抑制剂组合。
(8)默沙东ActRIIA融合蛋白3期临床达主要终点
11月26日,默沙东宣布其Winrevair(sotatercept)在3期临床试验ZENITH的中期分析中达到主要终点。Winrevair是一款“first-in-class”的IIA型激活素受体(ActRIIA)融合蛋白。它将ActRIIA经过改造的细胞外域与抗体的Fc端融合在一起。它可以阻断激活素与细胞膜上的受体结合,从而降低激活素介导的信号传导。ZENITH研究评估了Winrevair在肺动脉高压功能分级III或IV级且死亡风险较高的成人患者中的疗效和安全性。中期分析结果显示,Winrevair与安慰剂相比,显著降低了患者死亡或疾病恶化事件的风险(事件包括全因死亡、肺移植和因PAH恶化导致住院超过24小时)。这些患者均接受背景PAH治疗。基于这些结果,独立数据监察委员会建议ZENITH试验提前中止,所有参与者在开放标签扩展研究SOTERIA中均有机会接受Winrevair治疗。
(9)安进减重疗法MariTide 2期结果积极,平均体重减轻约20%
11月27日,安进公布其在研减重疗法MariTide在一项为期52周的临床2期研究的积极结果。分析显示,不伴T2D的肥胖或超重患者在接受MariTide治疗52周后,平均减重可达约20%,且未观察到减重平台期。而通常在胰高血糖素样肽1(GLP-1)类疗法中减重效果较差的T2D肥胖或超重患者中,MariTide实现了平均体重减轻约17%,同样未出现平台期。该患者群体在第52周时其平均糖化血红蛋白(HbA1c)水平降低了多达2.2个百分点。总体而言,两组队列患者均未出现体重减轻的停滞,显示出在52周后患者的体重可能继续下降。
(10)Alpheus创新疗法积极结果公布,晚期脑癌患者PFS延长约3倍
近日,Alpheus Medical宣布,其针对复发或难治性高级别胶质瘤患者的1/2期临床试验取得了积极结果。Alpheus Medical的SDT疗法是一种创新的非侵入性药物与医疗设备组合疗法,该疗法结合了低强度扩散超声(LIDU)与口服5-氨基乙酰丙酸(5-ALA),通过低强度、大范围超声靶向作用于整个脑半球的癌细胞,无需影像引导或镇静,即可针对患者的整个脑半球的癌细胞进行精准杀伤。这项1/2期试验是一项开放标签、多中心、治疗时长递增的研究,旨在评估Alpheus Medical专有SDT平台的安全性、最佳剂量和疗效。试验共招募了12名患者,分为三个组别,治疗时长分别逐步增加至每月60分钟、90分钟和120分钟。研究的主要发现包括:患者的中位OS:15.7个月(历史数据约为6-8个月),患者的中位PFS:5.5个月(历史数据约为1.8个月),安全性:未报告任何治疗相关死亡、严重不良事件(SAEs)或治疗时长限制毒性(DuLTs)。
同期事件:
1. 2024年第48周11.25-12.01国内创新药/改良型新药申请临床/获批临床/申请上市/获批上市数据分析
2. 2024年第48周11.25-12.01国内仿制药/生物类似物申报/审批数据分析
3. 2024年第48周11.25-12.01国内医药大健康行业政策法规汇总
4. 2024年第48周11.25-12.01全球医药大健康行业投融资数据
以上内容均来自{摩熵咨询医药行业观察周报(2024.11.25-2024.12.01)},如需查看或下载完整版报告,可点击!
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论